
| A. | ②③ | B. | ①③⑤ | C. | ①②④⑤ | D. | ③④ |
分析 以铜为电极,amol/L的硫酸铜溶液作电解液,对含有铁、锌、银的粗铜进行电解精炼,粗铜为阳极,纯铜为阴极,不活泼金属Ag沉积在阳极形成阳极泥,结合阴极反应Cu2++2e-=Cu计算.
解答 解:①粗铜应与电源的正极相连,作阳极,故错误;
②电子只能在导线中移动,不能进入溶液中移动,故错误;
③阴极与电池的负极相连,是电解质中的阳离子发生还原反应,即Cu2++2e-═Cu,故正确;
④在阳极上失电子的金属有铁、锌、铜,在阴极上得电子生成的金属只有铜,所以电解结束时溶液中溶质为硫酸铜、硫酸锌和硫酸亚铁,因此c(CuSO4)<amol/L,故正确;
⑤金属的活动性顺序为Zn>Fe>Cu>Ag,因此Ag不会放电,以单质形式沉积下来,故错误;
故选D.
点评 本题考查电解原理及应用,为高频考点,把握发生的电极反应为解答的关键,侧重分析与应用能力的考查,注意电子不能进入溶液,题目难度不大.


科目:高中化学 来源: 题型:选择题
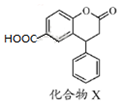
| A. | X的分子式为C16H11O4 | |
| B. | X分子中有三种不同的官能团 | |
| C. | 1 mol化合物X最多能与3 mol NaOH反应 | |
| D. | X分子中两个苯环一定处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 用铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中无K+ |
| B | 向溶液中先滴加稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 | 溶液中一定含有SO42- |
| C | 向一定浓度的CuSO4溶液中通入适量H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-向正极移动 | |
| B. | 负极发生的电极反应是:O2+2CO2+4e-═2CO32- | |
| C. | 负极发生的电极反应是:CO+CO32--2e-═2CO2 | |
| D. | 正极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3OH.
CH3OH. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
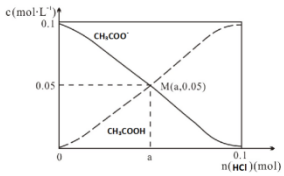
| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(H+)-n(OH-)=(0.05-a )mol | |
| C. | 随着HCl的加入,$\frac{c(O{H}^{-})}{c(C{H}_{3}COO{H}^{-})}$不断减小 | |
| D. | 当n(HCl)=0.1mol时,c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫单质在过量的空气中燃烧生成SO2 | |
| B. | 自然界的硫元素主要以硫化物和硫酸盐等形式存在,无硫单质 | |
| C. | 二氧化硫和氯气使品红溶液褪色的原理不相同 | |
| D. | 浓硫酸与碳在一定条件下的反应,体现了浓硫酸的强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com