
A��B��D��E��YΪ5�ֶ�����Ԫ�ء�
��A��B��Dλ��ͬһ���ڣ�D��Yλ��ͬһ���塣A��ԭ�ӵ��������������������������2����
��D���⻯������õ��ܼ���E�ĵ�����һ�������г����Ľ�����
��ش�
��1��AD2�о��еĻ�ѧ���������� ��
��2������ʱ��6 gA�ĵ�����D����̬�⻯�ﷴӦ���������ֻ�ԭ�����壬���յ�����Ϊ65��75 kJ���䷴Ӧ���Ȼ�ѧ����ʽ�� ��
��3��D����Ԫ�ؿ���ɺ���10�����ӵ�Xһ����Xһ���Ԫ����ͬ��ԭ����������Ҳ��ͬ�ķ��ӵĵ���ʽ�� ��
��4��YD2����ͨ������BaCl2��B������������Ӧ��ˮ����Ļ����Һ�У����ɰ�ɫ��������ɫ���壬��Ӧ�����ӷ���ʽ�� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ����ͨ����Ũ������Ҵ���Ӧ����ȡ��ϩ�������¶ȹ��߶����������Ķ������������������ʵ����ȷ�������������������ϩ�Ͷ��������Իش��������⡣
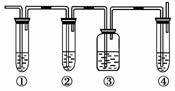
(1)ͼ�Т١��ڡ��ۡ���װ�ÿ�ʢ�ŵ��Լ��ֱ��ǣ�
��________����________����________����________(�������й��Լ��������)��
A��Ʒ����Һ B��NaOH��Һ
C��Ũ���� D������KMnO4��Һ
(2)��˵����������������ڵ�������
________________________________________________________________________��
(3)ʹ��װ�âں͢۵�Ŀ����
____________________________________________________��
(4)˵��������ϩ��������
______________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������л���Ľṹ�������йص�������ȷ����(����)
A��������֬������ʹ����KMnO4��Һ��ɫ
B�������Cl2�ķ�Ӧ����ϩ��Br2�ķ�Ӧ����ͬһ���͵ķ�Ӧ
C�������ǡ����ǵķ���ʽ��ΪC6H12O6������Ϊͬ���칹��
D���Ҵ������������Na��Ӧ�ų�H2�����߷����й�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2 L���ܱ������У��������·�Ӧ��2A(g) + B(g) 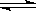 2C(g) + D(g)������������A��B����3 mol����ǰ10 s A�Ļ�ѧ��Ӧ����Ϊ0.12 mol/(L��s)����10 sʱ��������B�����ʵ�����
2C(g) + D(g)������������A��B����3 mol����ǰ10 s A�Ļ�ѧ��Ӧ����Ϊ0.12 mol/(L��s)����10 sʱ��������B�����ʵ�����
A��0.6 mol B��1.2 mol C��2.4 mol D��1.8 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��N2 (g) + 3H2(g) 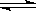 2NH3(g) ��H=��92.4 kJ��mol��1 �����¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
2NH3(g) ��H=��92.4 kJ��mol��1 �����¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol N2��3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3��Ũ�ȣ�mol��L | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�a kJ | ����b kJ | ����c kJ |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 |
| ��Ӧ��ת���� |
|
|
|
����˵����ȷ����
A��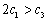 B��
B��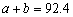 C��
C��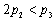 D����1 +��2 > 1
D����1 +��2 > 1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Щ��ѧ��������ǡ�21���͵���Դ��������Ҫ��������Ϊ�뵼����ϵĹ���̫����
��������о�����Ҫ�����á����й��ڹ輰�仯�����˵����ȷ����(����)
A��ˮ�ࡢ������ˮ�����ﶼ�ǹ�������Ʒ��
B�������£������Թ�����ɽ�̿��ʯӢɰ(SiO2)��ȡ��ķ�Ӧ
C����ʯ�Ļ�ѧ�ɷ�ΪCa2Mg5Si8O22(OH)2д�����������ʽΪ��2CaO��5MgO��8SiO2��H2O
D����Ȼ���й�Ԫ�ص������ḻ�������ڴ����ĵ��ʹ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijͬѧ�����ˡ�84����Һ��˵���е��䷽������NaClO��������480 mL�� NaClO 25%���ܶ�Ϊ1.19 g/cm3������Һ������˵����ȷ����(����)
A������ҡ�Ⱥ���������Һ��������NaClO�����ʵ���Ũ��ƫС
B������ƿ������ˮϴ��������ɲ���������Һ������
C������õ�NaClO����Һ�ڿ����й��գ����ú���Һ��NaClO�����ʵ���Ũ�ȼ�С
D����Ҫ������NaClO���������Ϊ142.8 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2014��5��������ѧ���о����֣��������������ӿ�����̼��������ˮ�γ�����ˮ�����ԭ�������ڿ�ȼ�����γɣ������о������ܽྻ��ȫ�ش�������������˵����ȷ����
A��̼������ˮ���ﴢ����������ѧ�仯
B��̼��������ʯ��Ϊͬ��������
C������ˮ�������ȼ����ͬһ����
D�������������ڵ�ˮ�����γɹ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ѧС������ͼ��ʾװ����ȡ����������˵����ȷ����(����)

A����װ��ͼ�����ٴ����������Դ���
B����ʵ�����ռ������ķ�������ȷ
C�������Ҫ�õ����﴿����Cl2��ֻ�������巢��װ�ú��ռ�װ��֮������һ��װ��Ũ�����ϴ��ƿ����
D������2 mol HCl��ijŨ����������MnO2��ϣ���һ�������·�Ӧ��ת��1 mol����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com