
 2C(g)
2C(g)
 2C(g)������N�дﵽƽ�⣬��������к���A 1.0mol��B 0.4mol��C 0.4mol����ʱ�ݻ�Ϊ2.0L����������µ�ƽ�ⳣ��Ϊ �������¶Ⱥ�ѹǿ���䣬���������ͨ��0.36mol A��ƽ�⽫ ������������������ƶ����ü�Ҫ�ļ������˵������
2C(g)������N�дﵽƽ�⣬��������к���A 1.0mol��B 0.4mol��C 0.4mol����ʱ�ݻ�Ϊ2.0L����������µ�ƽ�ⳣ��Ϊ �������¶Ⱥ�ѹǿ���䣬���������ͨ��0.36mol A��ƽ�⽫ ������������������ƶ����ü�Ҫ�ļ������˵������  2C(g)
2C(g)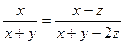 ����x=y
����x=y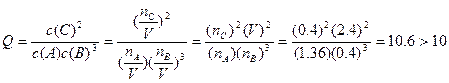 ��4�֣�
��4�֣�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 )
) 2NH3(g) ��H=��92.4kJ/mol
2NH3(g) ��H=��92.4kJ/mol

 2NH3(g)��Ӱ�죮ʵ������ͼ��ʾ��(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)
2NH3(g)��Ӱ�죮ʵ������ͼ��ʾ��(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
 I3����ͨ����ƽ����ϵ��c(I2)��c(I��)��c(I3��)���Ϳ���ø÷�Ӧ��ƽ�ⳣ����
I3����ͨ����ƽ����ϵ��c(I2)��c(I��)��c(I3��)���Ϳ���ø÷�Ӧ��ƽ�ⳣ����
 ��һ������(��Kd��ʾ����Ϊ����ϵ��)��������������Kd��85���ش��������⣺
��һ������(��Kd��ʾ����Ϊ����ϵ��)��������������Kd��85���ش��������⣺ I3����ƽ�ⳣ��K=__________���þ��������г�����ʽ���ɣ�����
I3����ƽ�ⳣ��K=__________���þ��������г�����ʽ���ɣ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)��673 K��30 MPa��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ������������ȷ����( )
2NH3(g)��673 K��30 MPa��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ������������ȷ����( ) 
| A����e������Ӧ���ʱȵ�d�Ĵ� |
| B����c����Ӧ�ﵽƽ�� |
| C����d��t1ʱ�̣��͵�e��t2ʱ�̣���n��N2����ͬ |
| D���ڸ��������£�t1ʱ��NH3�ĺ����ﵽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

 4NO(g)��6H2O(g) ��H= ��808.7 kJ/mol
4NO(g)��6H2O(g) ��H= ��808.7 kJ/mol NO2(g)+NO(g) ��H= ��41.8 kJ/mol
NO2(g)+NO(g) ��H= ��41.8 kJ/mol 2HNO3(l)��NO(g) ��H= ��261.3 kJ/mol
2HNO3(l)��NO(g) ��H= ��261.3 kJ/mol 2CO(g) ��H= ��171.4kJ/mol
2CO(g) ��H= ��171.4kJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
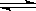 p C(g)��ƽ�ⳣ��ΪK�����ж�K��˵����ȷ����
p C(g)��ƽ�ⳣ��ΪK�����ж�K��˵����ȷ����| A��KֵԽ�����÷�ӦԽ������C�����ɣ���Ӧ���ת����Խ�� |
| B������С��Ӧ�����ݻ�����ʹƽ�������ƶ�����K���� |
| C���¶�Խ�ߣ�Kһ��Խ�� |
| D�����m+n==p����K=1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2AB(g)�ﵽƽ��ı�־��( )
2AB(g)�ﵽƽ��ı�־��( )| A����λʱ��������n molA2ͬʱ����n molAB |
| B����λʱ��������2n molAB��ͬʱ����n molB2 |
| C��������������ѹǿ������ʱ��ı仯���仯 |
D������ �ڻ�������ƽ��Ħ������������ʱ��ı仯���仯 �ڻ�������ƽ��Ħ������������ʱ��ı仯���仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 xC��g�� ��H��0
xC��g�� ��H��0
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com