
| A. | KNO3溶液 | B. | NaCl溶液 | C. | AgNO3溶液 | D. | CuCl2溶液 |
分析 A.电解KNO3溶液,发生反应:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,KNO3浓度增大,但KNO3溶液为中性;
B.电解NaCl溶液,发生反应:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,有NaOH生成;
C.电解AgNO3溶液,发生反应:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+4HNO3+O2↑,有硝酸生成;
D、电解CuCl2溶液,发生反应::CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑.
解答 解:阳离子的放电顺序为:Ag+>Cu2+>H+>Na+>K+,阴离子的放电顺序为:I->Br->Cl->OH-,
根据离子的放电顺序,电解各溶液的电解方程式分别为:
A、电解KNO3溶液实际是电解水,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,所得溶液仍是硝酸钾溶液,只是浓度增大,呈中性.
B、电解NaCl溶液的电解方程式为:2 NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2NaOH,所得溶液为氢氧化钠溶液,呈碱性;
C、电解Ag NO3溶液的电解方程式为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,所得溶液为硝酸溶液,呈酸性;
D、电解CuCl2溶液的电解方程式为:CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑,所得液体为水;
所以溶液pH最大的是B,故选B.
点评 本题考查了电解原理,知道阴阳离子的放电顺序解本题的关键;电解电解质溶液时,电解类型有:电解水型、电解电解质型、电解电解质和水型,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 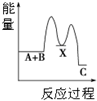 反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0),图表示总反应过程中能量变化 | |
| B. | 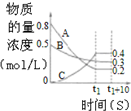 图表示反应的化学方程式为3A+B═2C | |
| C. | 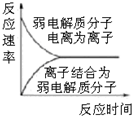 图表示弱电解质在水中建立电离平衡的过程 | |
| D. | 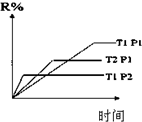 图表示反应M(g)+N(g)?R(g)+2L(?)是放热反应且L是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol | |
| B. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ/mol | |
| C. | 氢气的燃烧热为285.8 kJ/mol,则水电解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol,则可知C的燃烧热为11.5KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(I-)=0.1mol•L-1的溶液中:K+、Na+、SO42-、ClO- | |
| B. | 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 与Al反应能放出大量H2的溶液中:Cl-、Na+、NO3-、Fe2+ | |
| D. | 由水电离出的c(OH-)=1×10-10mol.L-1的溶液中:Ba2+、K+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加LaNi5H6(s)的量 | B. | 降低温度 | ||
| C. | 减小压强 | D. | 使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓硝酸加水稀释后都能与金属铜反应 | |
| B. | 浓硫酸和浓硝酸都不能用来直接跟锌粒反应制氢气 | |
| C. | 浓硫酸和浓硝酸在常温下都能用金属铝制容器盛放 | |
| D. | 浓硫酸和浓硝酸都能与单质碳反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱、液态氧、碘酒 | B. | 干冰、铁、冰水混合物 | ||
| C. | 生石灰、白磷、熟石灰 | D. | 碱石灰、氮气、胆矾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com