
| A. | 常温常压下,32克 O2与O3所含的原子数目相同,均为NA | |
| B. | 46克的NO2和N2O4混合气体中含原子数目为3 NA | |
| C. | 18克的NH4+中含有电子数为NA | |
| D. | 28 g Fe变为离子时,失去的电子数一定为NA |
分析 A、氧气和臭氧均由氧原子构成;
B、NO2和N2O4的最简式均为NO2;
C、求出铵根离子的物质的量,然后根据铵根离子为10电子微粒来分析;
D、根据铁反应后可能变为+2价也可能变为+3价来分析.
解答 解:A、氧气和臭氧均由氧原子构成,故32g无论是氧气还是臭氧中含有的氧原子的物质的量均为n=$\frac{32g}{16g/mol}$=2mol,即2NA个,故A错误;
B、NO2和N2O4的最简式均为NO2,故46g混合气体中含有的NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含3mol原子即3NA个,故B正确;
C、18g铵根离子的物质的量为1mol,而铵根离子为10电子,故1mol铵根离子中含10mol电子即10NA个,故C错误;
D、由于反应后铁可能变为+2价也可能变为+3价,故28g铁即0.5mol铁反应后失去的电子可能为NA个,也可能为1.5NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

| A. | 温度升髙,该反应的平衡常数减小 | |
| B. | 0〜10min,HCOOCH3的平均反应速率v=0.003mol•L-1min-1 | |
| C. | HCOOCH3水解平均反应速率先是增大,后减小,最后保持不变 | |
| D. | 该条件下达到平衡状态,反应物转化率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CH3OH)=0.3 mol•(L•min)-1 | B. | v(O2)=0.4 mol•(L•min)-1 | ||
| C. | v(NaOH)=0.5 mol•(L•min)-1 | D. | v(Na2CO3)=0.01 mol•(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 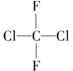 和 和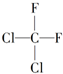 是两种不同的物质 是两种不同的物质 | |
| B. | 聚氯乙烯的单体为CH2═CHCl | |
| C. | 乙烷和乙烯均能使酸性KMnO4溶液褪色 | |
| D. | 1 mol乙酸与足量乙醇在浓硫酸催化下加热,可生成1 mol乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将4.6 g金属钠放入95.4 g蒸馏水中,可得到溶质质量分数为8%的溶液 | |
| B. | 金属钠与水的反应实质上是与水电离产生的H+反应 | |
| C. | 将金属钠投入饱和NaCl溶液中,会有晶体析出,钠的性质活泼,故应保存在CCl4中 | |
| D. | 做有关钠的性质实验时,剩余的Na不用放回原试剂瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200ml 2mol/L Mg Cl2溶液 | B. | 1000 ml 2.5 mol/LNaCl | ||
| C. | 300 ml 5 mol/L K Cl 溶液 | D. | 250 ml 1 mol/L AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
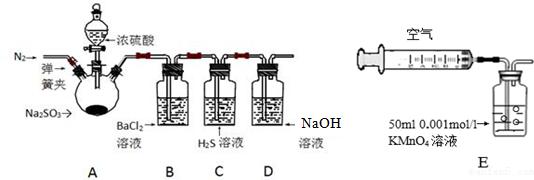
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管中,滴入几滴酚酞 | 溶液变红 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成符合CnH2n-2通式的链烃一定是炔烃 | |
| B. | 炔烃既易发生加成反应,又易发生取代反应 | |
| C. | 炔烃既能使溴水褪色,也能使酸性高锰酸钾溶液褪色 | |
| D. | 炔烃分子里所有的碳原子都在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6molCaO | B. | 0.2molH2SO4 | C. | 0.15molH3PO4 | D. | 0.4molMgCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com