


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 反应达平衡时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
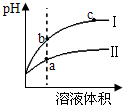
| A、等pH的硫酸与醋酸稀释后pH的变化如图所示,则曲线Ⅱ表示的是醋酸的稀释图象 |
| B、溶有等物质的量的NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C、若NH4HCO3溶液、NH4HSO4溶液中c(NH4+)相等,则:c(NH4HSO4)<c(NH4HCO3) |
| D、已知某温度下Ksp(CH3COOAg)=2.8×10-3,浓度均为0.1 mol?L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某物质中含有一种元素,则该物质一定是纯净物 |
| B、金刚石和石墨之间的转变一定是化学变化 |
| C、不同物质其相对分子质量一定不同 |
| D、不同的原子可相互组合成复杂的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电极材料为铁和锌,电解质溶液为FeCl3溶液 |
| B、电极材料为铁,电解质溶液为 Fe(NO3)3溶液 |
| C、电极材料为铁和铜,电解质溶液为FeCl3 溶液 |
| D、电极材料为石墨,电解质溶液为 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 | B、烧碱溶液 |
| C、氨水 | D、KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某雾霾天气的空气质量指数(AQI)显示首要污染物为PM2.5(指大气中直径小于或等于2.5微米的颗粒物)PM2.5在空气中形成气溶胶 |
| B、氢键、分子间的作用力、离子键和共价键均为微粒间的相互作用力 |
| C、纸层析法、李比希燃烧法、钠溶法、铜丝燃烧法都是元素定性分析法 |
| D、纤维素、PLA、油脂、甲壳素、硝化纤维等都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com