
某元素最高价氧化物的水化物的化学式为HxROy,气态氢化物的化学式为HxR,已知1 mol HxROy比1 mol HxR质量多64 g,又知道1 mol HxROy中R的原子核外电子总数比氢原子和氧原子核外电子总数少16 mol,求R的原子序数。
科目:高中化学 来源: 题型:
一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6 g,若其中水的质量为10.8 g,则CO的质量是( )
A.1.4 g B.2.2 g
C.4.4 g D.在2.2 g和4.4 g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验研究中经常用到定量分析。
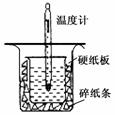 I.取0.55 mol/L的NaOH溶液50mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
I.取0.55 mol/L的NaOH溶液50mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
(1)从右图实验装置看,装置中的一个明显错误是
。
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热数值
会_________,(填“偏大”、“偏小”、“ 不变”)
(3)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55 mol·L-1NaOH 溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”),简述理由 。
Ⅱ.某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
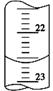 请回答:
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致
测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:________________,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组对还原铁粉与水蒸气的反应及产物进行科学探究。
 (1)根据右图所示实验装置,同学们进行了还原铁粉与水蒸气反应的实验。实验中使用肥皂液检验的产物是 ;图中湿棉花的作用是 ;铁粉与水蒸气反应的化学方程式是 。
(1)根据右图所示实验装置,同学们进行了还原铁粉与水蒸气反应的实验。实验中使用肥皂液检验的产物是 ;图中湿棉花的作用是 ;铁粉与水蒸气反应的化学方程式是 。
(2)甲同学为了进一步确定反应是否发生,对实验后试管内残留黑色固体的成分进行了下列实验探究:
(查阅资料可知:Fe3O4 + 8HCl(浓)  FeCl2 + 2FeCl3 + 4H2O)
FeCl2 + 2FeCl3 + 4H2O)
| 实验序号 | 实验操作 | 实验现象 |
| ① | 取少量残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产 生,溶液呈浅绿色。 |
| ② | 向上述烧杯中滴加几滴KSCN溶 液,充分振荡 | 溶液没有出现红色 |
根据上述实验现象,不能完全确定残留固体的成分,但肯定能确定残留黑色固体中含有的一种物质是 (填化学式);
(3) 乙同学也进行了下列实验探究以证明实验后试管内残留黑色固体是否存在Fe3O4。
| 实验序号 | 实验操作 | 实验现象 |
| ① | 称取14.4g残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
| ② | 向上述烧杯中加入足量的氯水,充分振荡 | 溶液呈黄色 |
| ③ | 向上述烧杯中加入足量NaOH溶液,过滤、洗涤、干燥、称量 | 得到21.4g红褐色固体 |
根据乙同学的实验现象和数据,残留黑色固体中Fe3O4的质量是 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关原子结构及元素周期律的叙述正确的是( )
A.第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子
B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小
C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强
D.同主族元素从上到下,单质的熔点逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ·mol-1
B.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度
C.在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.31 kJ·mol-1。若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
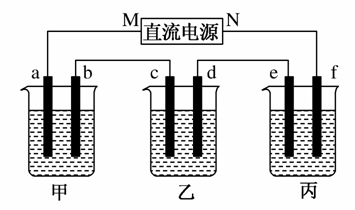
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,②中c电极质量增加。据此回答问题:
(1)电源的N端为________极;
(2)电极b上发生的电极反应为__________________________;
(3)列式计算电极b上生成的气体在标准状况下的体积:_______
_________________________________________________________;
(4)电极c的质量变化是________g;
(5)电解前后各溶液的酸、碱性大小是否发生变化,并简述其原因:
①溶液_______________________________________________;
②溶液_______________________________________________;
③溶液_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
车用乙醇汽油就是把燃料乙醇和汽油按一定比例混合配形成的车用燃料。结合有关知识,回答以下问题。
(1)乙醇的结构简式为________。汽油是由石油分馏所得的低沸点烷烃,其分子中的碳原子数一般在5~12范围内,如戊烷,其分子式为______________。
(2)乙醇可由含淀粉的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出由淀粉制乙醇的化学方程式:
________________________________________________________________________,
________________________________________________________________________。
(3)若1 mol乙醇充分燃烧生成二氧化碳气体和液态水放热1367 kJ,乙醇燃烧的热化学方程式是:
________________________________________________________________________________________________________________________________________________。
(4)车用乙醇汽油被称为环保燃料,其原因是________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com