

 ,含有离子键和共价键,
,含有离子键和共价键, ;离子键、共价键;
;离子键、共价键; ,
, ;
;| 15.68L |
| 22.4L/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
| A、塑料垃圾可直接露天焚烧 |
| B、实施“禁塑令”有助于遏制白色污染 |
| C、纤维素、油脂、蛋白质均属于有机高分子 |
D、聚丙烯结构式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为
C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为 ,其中R、R′为烃基.请回答以下问题:
,其中R、R′为烃基.请回答以下问题: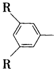 ,且属于酯的所有同分异构体的结构简式
,且属于酯的所有同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
 20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系如图所示.(体积变化忽略不计)
20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系如图所示.(体积变化忽略不计)查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
| C、向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com