
 (1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、通H2的一极是正极,通O2的一极是负极 |
| B、通O2的一极是正极,通H2的一极是负极 |
| C、工作一段时间后电解质溶液pH增大 |
| D、此电池能发出淡蓝色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知2SO2+O2?2SO3的正反应为放热反应,则SO2的能量一定高于SO3的能量 |
| B、热化学方程式前面的化学计量数代表分子个数 |
| C、S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)═SO2(g)△H2,则△H1<△H2 |
| D、已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Na2O2+2H2O═4NaOH+O2↑ | ||||
B、C+H2O
| ||||
| C、Na2O+H2O═2NaOH | ||||
| D、2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯离子的结构示意图: | ||
B、作为相对原子质量测定标准的碳核素:
| ||
C、氯化镁的电子式: | ||
D、用电子式表示氯化氢分子的形成过程: + + → →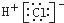 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 沉淀物 | Fe (OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com