

 ;苯和溴易挥发,二者易溶于四氯化碳,所以用四氯化碳来吸收苯和溴,HBr难溶于四氯化碳,不被吸收;
;苯和溴易挥发,二者易溶于四氯化碳,所以用四氯化碳来吸收苯和溴,HBr难溶于四氯化碳,不被吸收; ;吸收溴和苯的蒸气;
;吸收溴和苯的蒸气;

 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
| A、①② | B、②④ | C、①③ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C4H8可能是烯烃 |
| B、C4H8中属于烯烃类的同分异构体有4种 |
C、核磁共振氢谱有2种吸收峰的烯烃结构一定是  |
| D、C4H8中属于烯烃的顺反异构体有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0).试回答下列问题:
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0).试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
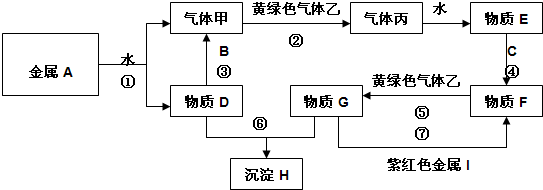
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3是极性分子,为三角锥形 |
| B、双原子分子中的共价键,一定是非极性键 |
| C、非极性键也可能存在于离子化合物中 |
| D、CO2是非极性分子,分子中C原子处在2个O原子所连成的直线的中央. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com