
| A. | ①②③④⑤ | B. | ①③④⑤⑥ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
分析 ①一个S8分子(其“皇冠”结构如图)中含有的S-S键个数为8个;
②根据粗铜中含有摩尔质量比铜小且活泼性比铜大的杂质分析;
③硫化钠和过氧化钠的摩尔质量相等,1mol过氧化钠中含有1mol阴离子;
④二氧化硫和氧气反应是可逆反应不能进行彻底;
⑤质量换算物质的量结合化学式计算;
⑥只有浓硫酸与铜反应,稀硫酸与铜不反应.
解答 解:①一个S8分子(其“皇冠”结构如图)中含有的S-S键个数为8个,32gS8单质物质的量=$\frac{32g}{8×32g/mol}$=0.125mol,含有的S-S键个数为NA,故正确;
②电解精炼铜时转移了NA个电子,电子的物质的量为1mol,阳极的粗铜中含有铁锌等杂质,活泼性均大于铜的,所以电解时先失去电子,所以转移0.5mol电子,阳极溶解的铜的物质的量小于0.5,质量小于32g,故错误;
③1mol过氧化钠中含有1mol阴离子,7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA,故错误;
④可逆反应不能进行彻底,2molSO2和1molO2,混合气体在催化剂作用下反应容器中物质分子数大于2NA,故正确;
⑤2.9g 2CaSO4•H2O物质的量=0.01mol,含有的结晶水分子数为0.01NA,故错误;
⑥随着反应进行,硫酸浓度降低,不再与铜反应,所以生成SO2的分子数小于0.1NA.故错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 物质 | HCOOH | CH3OH | HCOOCH3 |
| 主要 性质 | 无色液体,与水互溶 K(HCOOH)>K(CH3COOH) | 无色液体,与水互溶 | 无色液体,在水中溶解度小,与醇互溶 |
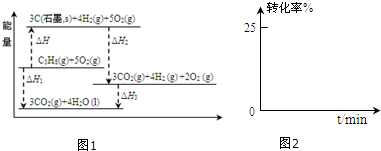
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象 | 结论 |
| A | Cl2、SO2分别通入紫色石蕊溶液中,溶液均褪色 | 二者均有漂白性 |
| B | CO2、SO2分别通入Ba(NO3)2溶液中,均无沉淀生成 | 弱酸不能制强酸 |
| C | 向溶液中滴加盐酸,产生的气体通入澄清石灰水中,石灰水变浑浊 | 该溶液中一定有CO32- |
| D | 将钾、钠分别放入装有煤油的试管中,二者均下沉到试管底部 | 钾、钠的密度都比煤油大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a一定是KOH | B. | c一定是A1C13 | C. | e一定是MgC12 | D. | b一定是KHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
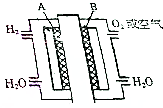 为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;
为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
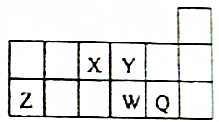 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )| A. | 元素X的最低化合价绝对值与元素X的最高正化合价之和的数值等于8 | |
| B. | 简单离子半径的大小顺序为:Z3+>W2->Q->Y2- | |
| C. | Y与氢元素形成的化合物中均只含极性共价键 | |
| D. | 最高价的X与Q形成的化合物中,各原子都为8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
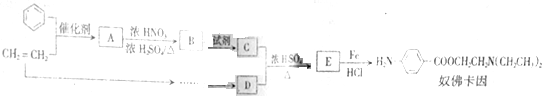
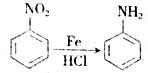
 ,生成A的反应类型为加成反应.
,生成A的反应类型为加成反应.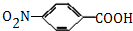 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
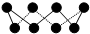
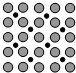 ①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com