
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)

序号 | A溶液 | B溶液 |
① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是探究________________对化学反应速率的影响.
(2)分液漏斗中A溶液应该_____________加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是____________________.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/ml | 10 | 5 | 0 | X |
0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
时间/s | 40 | 20 | 10 | ﹣﹣﹣ |
(4)X=____________
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是____________
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0 kJ•mol-1表示放热反应,△H<0 kJ•mol-1表示吸热反应 | |
| C. | 1 mol H2SO4与1 molBa(OH)2反应生成H2O时放出的热叫做中和热 | |
| D. | 1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中不可能含有离子键 | |
| B. | 只有金属元素和非金属元素才能形成离子键 | |
| C. | 水分子很稳定,因为水分子间存在氢键 | |
| D. | 所有的分子晶体内都存在两种以上作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现象相同,沉淀量相等 | B. | 现象相同,沉淀量不等 | ||
| C. | 现象不同,沉淀量相等 | D. | 现象不同,沉淀量不等 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是( )
A、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的 转化率
转化率
B、合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率;
C、在实验室里,可用碳酸钙粉末和稀盐酸制得二氧化碳气体;
D、实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
反应C(s)+H2O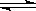 CO(g)+H2(
CO(g)+H2( g)△H>0,达到平衡时,下列说法正确的是( )
g)△H>0,达到平衡时,下列说法正确的是( )
A.加入催化剂,平衡常数不变 B.减小容器体积,正、逆反应速率均减小
C.增大C的量,H2O的转化率增大 D.升高温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
已知:①CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-akJ·mol一 1
1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-bkJ·mol一1
③CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-ckJ·mol一1
则下列叙述正确的是
A.由上述热化学方程式可知b>c
B.甲烷的燃烧热为bkJ/mol
C.2CH3OH(g)=2CH4(g) +O2(g) △H=2(b一a)KJ? mol一1
D.当甲醇和甲烷物质的量之比为1:2时,其完全燃烧生成CO2和H2O(1)时,放出的热量 为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b) mol
为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b) mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com