
| A. | 19:8 | B. | 22:1 | C. | 13:8 | D. | 8:13 |
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 同温同压下两种气体的体积之比等于摩尔质量之比 | |
| B. | 同温同压下两种气体的物质的量之比等于密度之比 | |
| C. | 同温同压下两种质量相同的气体其体积比之比等于摩尔质量之比 | |
| D. | 同温同体积下两种气体的物质的量之比等于压强之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
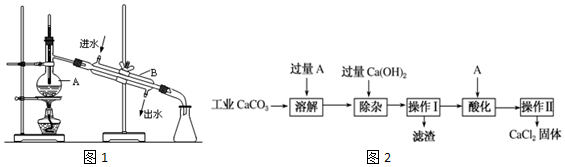
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液 | B. | 胶体 | C. | 浊液 | D. | 气溶胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子中3个碳原子都是sp3杂化 | |
| B. | 每个丙烯分子有7个σ键,1个π键 | |
| C. | 丙烯分子是存在非极性键和极性键的极性分子 | |
| D. | 丙烯分子为手性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1装置制取并收集干燥纯净的NH3 | |
| B. | 用图2装置可演示NO的喷泉实验 | |
| C. | 用图3装置制备Fe(OH)2并能较长时间观察其颜色 | |
| D. | 用图4装置验证苯中是否有独立的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
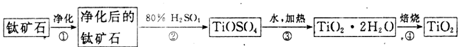
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com