
化学是以实验为基础的科学,以下说法正确的是( )
A.用硫酸酸化高锰酸钾溶液,能起到增强氧化性作用
B.向某溶液中加入稀NaOH溶液未能产生使湿润的红色石蕊试变蓝的气体,说明原溶液中不含NH4+
C.在坩埚中加热MgCl2·6H2O晶体可以得到无水MgCl2
D.向某溶液中加入稀盐酸能产生使品红溶液褪色的气体,说明原溶液中一定含有SO32-
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源:2016届云南省高三下第七次月考理综化学试卷(解析版) 题型:选择题
邻甲基苯甲酸有多种同分异构体,其中属于酯类且分子结构中有—CH3和苯环的同分异构体有
A.6种 B.5种 C.4种 D.3种
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:选择题
碳、硫、氧、氮是中学常见元素,下列说法正确的是( )
A.CO2、SO2、NH 3都是直线形分子
B.CO2、NH3、H2S 的键角依次减小
C.H2O2、N2H4分子的中心原子都是sp3杂化
D.C、N、F元素的电负性依次减小
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:选择题
正确使用化学用语是学好化学的基础。以下化学用语的使用中不正确的是( )
A.酒精的实验式为:C2H6O
B.原子核中有7个中子的碳原子:136C
C.铝离子的电子式:Al3+
D.二氧化硅的结构式O=Si=O
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下冲刺模拟理综化学C卷(解析版) 题型:实验题
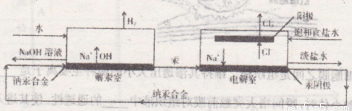
工业上可以用汞阴极法电解NaCl溶液得到烧碱与氯气、氢气,装置见下图:
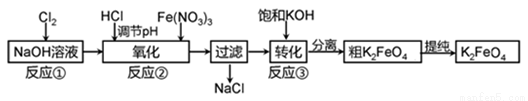
利用烧碱与氯气还可生产一种高效的多功能的水处理剂高铁酸钾。主要的生产流程如下:
(1)写出汞阴极法的阴极电极反应式_____________;解汞室内的反应化学方程式____________。
(2)反应原理如下:
反应①:Cl2+2NaOH=NaCl+NaClO+H2O
氧化过程化学方程式:______________________;
若加入过量NaClO,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式__________________;
转化过程:Na2FeO4+2KOH=K2FeO4+2NaOH,该过程在某低温下进行的,说明些温度下Ksp(K2FeO4)_____Ksp(Na2FeO4)(填“>”、“<”、“=”)。
(3)实验室在过滤时用到的玻璃仪器有______________________;
(4)既能起到杀菌作用又能起到净水作用,原因是其在水溶液中易水解产生氧气,请写出其水解化学方程式_____________________;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二6月月考化学试卷(解析版) 题型:填空题
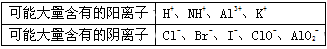
1L某混合溶液,可能含有的离子如下表:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。
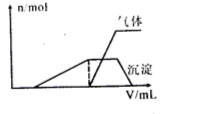
①则该溶液中一定含有的离子是 ;
②可能存在的阳离子有 ;
③肯定不存在的阴离子是 。
(2)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向2 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题。

①a的值为 ;
②当通入Cl2的体积为3.36 L(标准状态下)时,溶液中发生反应的离子方程式为 ;此时溶液中Br-、I-的物质的量浓度分别为c(Br-)= ,c(I-)= 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二6月月考化学试卷(解析版) 题型:选择题
某溶液中有NH4+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子组合是
A.NH4+、 Mg2+ B.Mg2+、Fe2+ C.NH4+、Fe2+ D.Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高一6月月考化学试卷(解析版) 题型:选择题
在密闭容器中充入一定量的NO2,发生反应2NO2(g) 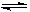 N2O4(g) ΔH=-57 kJ·mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
N2O4(g) ΔH=-57 kJ·mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是

A.a、c两点的反应速率:a>c
B.由a点到b点,可以用加热的方法
C.a、c两点气体的颜色:a深,c浅
D.a、b两点NO2的转化率:a<b
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁师大附中高一下学期6月月考化学试卷(解析版) 题型:填空题
在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:


(1)写出该反应的平衡常数表达式:K=___________________。已知:K(300℃)> K(350℃),该反应是________热反应。
K(350℃),该反应是________热反应。
(2)右图 中表示NO2的变化的曲线是_______。用O2表示从0~2s内该反应的平均速率v=_________。
中表示NO2的变化的曲线是_______。用O2表示从0~2s内该反应的平均速率v=_________。
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com