
2014年初雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)  2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
①该反应在 能自发进行(填“高温下” 、“低温下” 或“任何温度下”);
②在T2温度下,0~2 s内的平均反应速率v(N2)=___________。
(2)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
在恒压下,将CH4(g)和NO2(g)置于密闭容器中,也可以发生化学反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
| A.增加原催化剂的表面积 | B.降低温度 |
| C.减小投料比[n(NO2) / n(CH4)] | D.增大压强 |

(1)①低温下 ②0.025 mol·L-1·s-1
(2)BC (3)在250℃-450℃时,NOx转化率随温度升高而增大:反应未建立平衡,温度升高反应一定正向进行;450℃-600℃(温度较高)时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高反而减小。
结论二 相同温度下NO转化效率比NO2的低
解析试题分析;判断一个反应能否自发从吉布斯自由能的角度去判断。当吉布斯自由能小于0时,则能自发进行。由表中可知,T1达到平衡比较快。所以应该是T1大于T2。而T2生成的二氧化碳的量比较大,说明降低温度反应反应向正反应反向进行,所以正反应方向为放热反应。即ΔH小于零。而从反应物的气体量小于生成物的气体量,所以ΔS小于零而由ΔG=ΔH-TΔS要使ΔG小于零,则温度应该是在低温的情况下,所以该反应在低温下能自发进行。由表可算出二氧化碳的速率等于0. 1除以2等于0.050mol·L-1·s-1 。再据化学计量数之比等于化学反应速率之比可求出v(N2)等于0.025 mol·L-1·s-1 (2)由题意可知该反应为放热反应,降低温度,反应向正反应方向进行,减小投料比[n(NO2) / n(CH4)],相当于增大甲烷的量,减少二氧化氮的投放量,反应向正反应方向进行,因此答案选BC。(3))①在250℃-450℃时,NOx转化率随温度升高而增大:反应未建立平衡,温度升高反应一定正向进行;450℃-600℃(温度较高)时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高反而减小。
考点:考查化学反应速率以及化学平衡的相关知识点。


科目:高中化学 来源: 题型:单选题
可逆反应H2(g) + I2(g)  2HI(g)达到平衡的标志是
2HI(g)达到平衡的标志是
| A.H2、I2、HI的浓度相等 |
| B.H2、I2、HI的浓度之比为1:1:2 |
| C.混合气体的平均相对分子质量不变 |
| D.混合气体的颜色不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 
| A.t2时加入了催化剂 | B.t3时降低了温度 |
| C.t5时增大了压强 | D.t4~t5时间内转化率最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
( 5分)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:
2SO2(g)+O2(g) 2SO3(g) 2min末测得容器中有7.2mol SO2。试回答:
2SO3(g) 2min末测得容器中有7.2mol SO2。试回答:
① 反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③ 用O2的浓度变化表示该时间段内的化学反应速率_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(7分)在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol。A、C、D各为0.50mol,B的物质的量为x,当x的物质的量在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。达到平衡后,测得M的转化率为75%,填写空白:
(1)达到平衡后,反应器左室气体总的物质的量为 mol。
(2)若要使右室反应开始时V正>V逆,x的取值范围 。
(3)若要使右室反应开始时V正<V逆,x的取值范围 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(5分)在一密闭体系中发生下列反应A(g)+3B(g)  2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
(1)t1、t3、t4时刻体系中所改变的条件可能是:__________、__________、__________;
(2)C体积分数最高的时间段是__________。(填“tx-ty”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)某可逆反应从0—2分钟进行过程中, 在不同反应时 间各物质的量的变化情况如下图所示。则该反应的的反应物是 ,生成物是 ,化学方程式为 ;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为 _____ ,若不能,则其原因为 _ ________________ ;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态。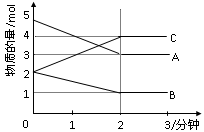
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)甲醇是重要的化工原料,在工业生产上的应用十分广泛。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。已知:
光催化制氢:2H2O(l)===2H2(g)+O2(g) ΔH=+571.5 kJ/mol ①
H2与CO2耦合反应:3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol ②
则反应:2H2O(l)+CO2(g) = CH3OH(l)+3/2O2(g)的ΔH= kJ/mol。
你认为该方法需要解决的技术问题有 (填字母)。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
①从原子利用率看,反应 (填“I”或“II”。下同)制甲醛的原子利用率更高。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。
②下图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示的是反应 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式: 。
(4)甲醇燃料电池的工作原理如图所示,则该电池负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(混有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压强1.0×105 Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com