
【题目】下列说法正确的是( )
A. 异戊烷的一溴代物和1,2—二甲基环己烷的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的所有原子在同一平面上
C. 按系统命名法,化合物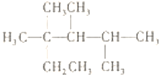 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. 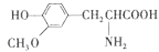 与
与![]() 二者互为同系物
二者互为同系物
【答案】A
【解析】
A.1,2—二甲基环己烷中的H原子有4种,异戊烷中的H原子也有4种,故它们的一溴代物均有4种,故A正确;
B.CH3CH=CHCH3可以看做是用两个甲基取代了乙烯中的2个H原子,而乙烯是平面结构,乙烯中的6个原子共平面,则用两个甲基取代了乙烯中的2个H原子后,所得CH3CH=CHCH3中的4个碳原子也共平面,但氢原子不共面,故B错误;
C. 烷烃命名时,要选最长的碳链为主链,故主链上有6个碳原子,故为己烷,并从离支链近的一端给主链上的碳原子进行编号,故在2号和3号碳原子上各有一个甲基,在4号碳原子上有两个甲基,故名称为2,3,4,4四甲基己烷,故C错误;
D. 结构相似,类别相同,在分子组成上相差一个或若干个CH2原子团的化合物互为同系物,而两者中的官能团不同,故不是同系物,故D错误。
故选A.


科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:回答下列问题:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___℃。此温度下加入2molCO2(g)和2molH2(g),充分反应,达到平衡时,H2的转化率为___。
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为:CO2(g)为2 mol/L,H2(g)为2mol/L,CO(g)为1mol/L,H2O(g)为3mol/L,则正、逆反应速率的关系为v(正)___v(逆)(填<、>、或=)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1
CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1
O2(g)=CO(g) H2=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1
O2(g)=H2O(l) H3=-285.8kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1
则甲烷水蒸气重整反应的△H=__kJ·mol-1。
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
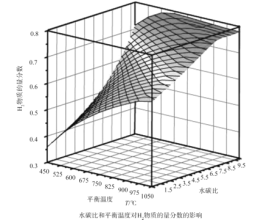
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__;其原因是__。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为__,其压强平衡常数为__;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=__(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
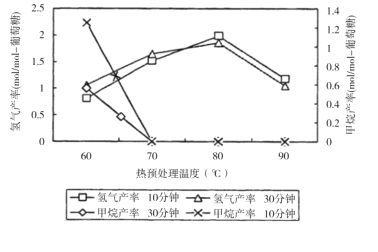
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为__;与甲烷水蒸气重整制氢相比其优点有__(至少写两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,将![]() 的醋酸溶液稀释到原体积的10倍后,溶液的
的醋酸溶液稀释到原体积的10倍后,溶液的![]()
B.常温下,若NaHA溶液的![]() ,则
,则![]() 是弱酸
是弱酸
C.用盐酸标准溶液滴定氨水至中性时,![]() 未被完全中和
未被完全中和
D.![]() 时
时![]() 溶液的
溶液的![]() 大于
大于![]() 时NaCl溶液的
时NaCl溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
由上述方程式可知:CH3OH的燃烧热________(填“大于”“等于”或“小于”)192.9 kJ/mol。
已知水的气化热为44 kJ/mol。则表示氢气燃烧热的热化学方程式为__________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式是_____________________________。
(3)已知:①Fe(s)+![]() O2(g)===FeO(s) ΔH1=-272.0 kJ/mol
O2(g)===FeO(s) ΔH1=-272.0 kJ/mol
②2Al(s)+![]() O2(g)===Al2O3(s) ΔH2=-1675.7 kJ/mol
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ/mol
Al和FeO发生铝热反应的热化学方程式是_____________________________________。该反应的自发性趋势很大,原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积可变的恒温密闭容器中按![]() 充入
充入![]() 和
和![]() ,发生反应:
,发生反应:![]()
![]() ,在t1时刻达到平衡状态I;在t2时刻向容器中充入一定量的
,在t1时刻达到平衡状态I;在t2时刻向容器中充入一定量的![]() ,t3时刻达到平衡状态Ⅱ。下列说法正确的是
,t3时刻达到平衡状态Ⅱ。下列说法正确的是
A.t1时刻达到平衡时,v(N2)=3v(H2)
B.t1时刻达到平衡时反应放出的热量小于Q kJ
C.达到平衡时,![]() 的体积分数:
的体积分数:![]()
D.![]() 过程中,v(逆)随时间变化如图所示
过程中,v(逆)随时间变化如图所示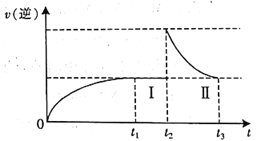
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2反应 B. 氧化铁与铝反应
C. 钠与乙醇反应 D. Ba(OH)2·8H2O与NH4C1反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体
a. 以上物质中能导电的是________________________________。
b. 以上物质中属于电解质的是_______________________,属于非电解质的是_______________________。
c. 以上物质中,溶于水且能导电的物质是_______________________。
(2)胶体和溶液的本质区别是________________,鉴别胶体和溶液所采用的方法是观察是否能发生___________效应。
(3)下列3个反应,按要求填写相关量。
①2Na2O2+2H2O=4NaOH+ O2↑反应中,每消耗1 mol Na2O2生成_____ g O2。
②在NaHCO3的热分解反应中,每消耗168 g NaHCO3,标准状况下生成_____L CO2。
③Cl2+H2O=HCl+HClO反应中,标准状况下每消耗22.4LCl2,转移_____mol电子。
(4)在一个密闭容器中放入以下四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下:
物质 | M | N | Q | P |
反应前质量(g) | 50 | 1 | 3 | 12 |
反应后质量(g) | x | 26 | 3 | 30 |
①该变化的基本反应类型是_____反应;
②物质Q在反应中起的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3AsO3是一种剧毒物,可加入祛毒剂SnCl2来除去,反应方程式为:2H3AsO3+3SnCl2+12X=2As↓+3H2SnCl6+6H2O。下列关于该反应的说法中正确的是( )
A.还原剂是H3AsO3
B.X的化学式为HCl,是该反应的氧化剂
C.每生成0.2molAs,还原剂得到0.6mol电子
D.该反应转移2mol电子,则消耗祛毒剂SnCl2为1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com