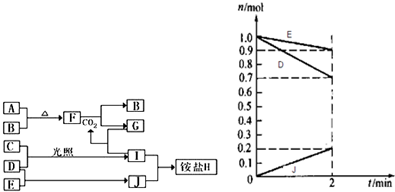
解:已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态,依据转化关系中的反应特征和条件C+D=I的反应条件是光照,推断为氢气和氯气的反应,I+J=铵盐H,说明I是HCl,J是NH
3,D为H
2,C、Cl
2,E为N
2,化合物G的焰色反应为黄色说明含钠元素,G+I=CO
2,证明G为碳酸盐;B是非金属单质是F和二氧化碳反应生成的,推断F为Na
2O
2,B为O
2,A为Na;
(1)H的化学式为NH
4Cl;晶体中所含化学键类型为离子键、共价键;检验H(NH
4Cl)中阳离子(NH
4+)的方法为:取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子,
故答案为:NH
4Cl;离子键、共价键;取少量H 样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子;
(2)A(Na)与B(O
2) 在加热条件下反应的主要现象是:剧烈反应,火焰为黄色,生成淡黄色的固体;F(Na
2O
2)和H
2O反应的化学方程式为:2Na
2O
2+2H
2O=4NaOH+O
2↑;G(NH
4Cl)溶液中加入过量的I(HCl)溶液反应的离子方程式:CO
32-+2H
+=CO
2↑+H
2O,
故答案为:剧烈反应,火焰为黄色,生成淡黄色的固体;2Na
2O
2+2H
2O=4NaOH+O
2↑;CO
32-+2H
+=CO
2↑+H
2O;
(3)由图中数据分析发生的反应为D+E=J,D、E消耗物质的量为n(H
2)=1.0mol-0.7mol=0.3mol;n(N
2)=1.0mol-0.9mol=0.1mol,生成J的物质的量为:n(NH
3)=0.2mol,反应物质的量之比为n(H
2):n(N
2):n(NH
3)=0.3mol:0.1mol:0.2mol=3:1:2,该反应的化学方程式为N
2+3H
2 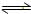
2NH
3;用J(NH
3)表示的反应速率=
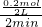
=0.05mol/L?min,
故答案为:N
2+3H
2 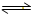
2NH
3;0.05mol/L?min.
分析:依据转化关系中的反应特征和条件C+D=I的反应条件是光照,推断为氢气和氯气的反应,I+J=铵盐H,说明I是HCl,J是NH
3,D为H
2,C、Cl
2,E为N
2,化合物G的焰色反应为黄色说明含钠元素,G+I=CO
2,证明G为碳酸盐;B是非金属单质是F和二氧化碳反应生成的,推断F为Na
2O
2,B为O
2,A为Na;依据推断出的物质进行分析回答问题.
点评:本题考查了物质转化关系和物质性质的应用,主要考查工业合成氨,工业制备盐酸,钠及其化合物性质的应用,化学反应速率计算,化学方程式计算判断.

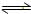 2NH3;用J(NH3)表示的反应速率=
2NH3;用J(NH3)表示的反应速率=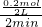 =0.05mol/L?min,
=0.05mol/L?min,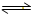 2NH3;0.05mol/L?min.
2NH3;0.05mol/L?min.

 阅读快车系列答案
阅读快车系列答案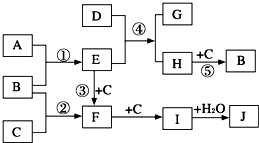 (2009?开封一模)如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).
(2009?开封一模)如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去). 如图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:
如图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格: