
| A. | Mg2+、Cl-、Al3+、SO42- | B. | Ba2+、Na+、SO42-、MnO4- | ||
| C. | K+、Cl-、HCO3-、CH3COO- | D. | Cu2+、NH4+、NO3-、K+ |
分析 强酸溶液含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能相互促进水解、发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.酸溶液中该组离子之间不反应,可大量共存,且离子均为无色,故A选;
B.MnO4-为紫色,与无色不符,且Ba2+、SO42-结合生成沉淀,不能共存,故B不选;
C.酸溶液中不能大量存在HCO3-、CH3COO-,故C不选;
D.Cu2+为蓝色,与无色不符,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 刷牙时适当使用含氟牙膏能够预防龋齿 | |
| B. | 缺锌的人可以服用硫酸锌糖浆或葡萄糖酸锌等补锌 | |
| C. | 人体内缺铁会使成人患甲状腺肿大 | |
| D. | 天然蛋白质水解的产物都是α-氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
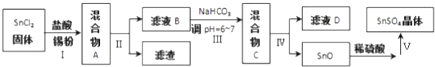
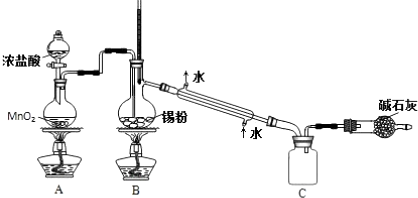
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
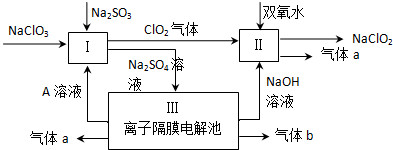
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于碘在乙醇中的溶解度较大,所以可用乙醇把碘水中的碘萃取出来 | |
| B. | 可用加热蒸馏的方法使含水乙醇变为无水乙醇 | |
| C. | 由于汽油和水不互溶,因此可用分液的方法将二者分离 | |
| D. | NaCl的溶解度随温度下降而减小,所以用冷却法从热的含少量KNO3的NaCl浓溶液中分离得到纯净的NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、NO3- | B. | Fe3+、K+、Cl-、HCO3- | ||
| C. | Cu2+、Na+、Cl-、SO42- | D. | K+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
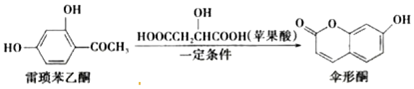
| A. | 雷琐苯乙酮有两种含氧官能团 | |
| B. | 1 mol伞形酮与足量 NaOH溶液反应,最多可消耗 2 mol NaOH | |
| C. | 伞形酮难溶于水 | |
| D. | 雷琐苯乙酮和伞形酮都能跟 FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42- 0.1 mol•L-1 | B. | Al3+ 0.2 mol•L-1 | ||
| C. | Cl- 0.3 mol•L-1 | D. | K+ 0.4 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com