
分析 (1)重铬酸钾溶液有强氧化性,能腐蚀橡胶管,液体加热时,加碎瓷片可以防止瀑沸;
(2)根据(NH4)2 Fe(SO4)2标准溶液的体积及浓度可以计算出剩余的重铬酸钾的物质的量,进而可以求得与有机物反应的重铬酸钾的物质的量,再根据电子得失守恒结合与有机物反应的重铬酸钾的物质的量求得试样的COD;
(3)a.步骤②未加入HgSO4,溶液中Cl-能消耗重铬酸钾,会导致与有机物反应的重铬酸钾的物质的量偏大;
b.步骤④未洗涤冷凝管等器壁,则用去的(NH4)2 Fe(SO4)2标准溶液偏少,所以计算得与有机物反应的重铬酸钾的物质的量偏大;
c.盛(NH4)2Fe(SO4)2标准溶液的滴定管滴定前有气泡,滴定过程中消失,则用去的(NH4)2 Fe(SO4)2标准溶液偏大,所以计算得与有机物反应的重铬酸钾的物质的量偏少;
d.读取(NH4)2Fe(SO4)2标准溶液滴定管读数时,滴定前平视,滴定后仰视,则读取的(NH4)2 Fe(SO4)2标准溶液偏大,所以计算得与有机物反应的重铬酸钾的物质的量偏少.
解答 解:(1)重铬酸钾溶液有强氧化性,能腐蚀橡胶管,所以量取10.00mL重铬酸钾溶液需使用酸式滴定管,液体加热时,加碎瓷片可以防止瀑沸,
故答案为:酸式滴定管;防止瀑沸;
(2)剩余重铬酸钾的物质的量为:
n(K2Cr2O7)=$\frac{1}{6}$×0.01 mol•L-1×24×10-3 L=4.000×10-5 mol
与有机物反应的K2Cr2O7为0.025 mol•L-1×10×10-3 L-4.000×10-5 mol=2.100×10-4 mol
据电子得失守恒有2Cr2${O}_{7}^{2-}$~3O2
故相当于消耗n(O2)=3.150×10-4 mol
m(O2)=3.150×10-4 mol×32 g•mol-1=10.08×10-3g=10.08 mg,所以COD=$\frac{10.08mg}{0.02000L}$=504 mg•L-1,
答:试样的COD为504 mg•L-1;
(3)a.步骤②未加入HgSO4,溶液中Cl-能消耗重铬酸钾,会导致与有机物反应的重铬酸钾的物质的量偏大,会导致测得的COD偏大;
b.步骤④未洗涤冷凝管等器壁,则用去的(NH4)2 Fe(SO4)2标准溶液偏少,所以计算得与有机物反应的重铬酸钾的物质的量偏大,会导致测得的COD偏大;
c.盛(NH4)2Fe(SO4)2标准溶液的滴定管滴定前有气泡,滴定过程中消失,则用去的(NH4)2 Fe(SO4)2标准溶液偏大,所以计算得与有机物反应的重铬酸钾的物质的量偏少,会导致测得的COD偏小;
d.读取(NH4)2Fe(SO4)2标准溶液滴定管读数时,滴定前平视,滴定后仰视,则读取的(NH4)2 Fe(SO4)2标准溶液偏大,所以计算得与有机物反应的重铬酸钾的物质的量偏少,会导致测得的COD偏小,
故选ab.
点评 本题是一道化学和生活相结合的题目,注重知识的迁移应用,能较好的考查学生分析和解决问题的能力,为高考常见题型和高频考点,题目信息量较大,注意把握题给信息,答题时仔细审题,难度中等.


科目:高中化学 来源: 题型:选择题
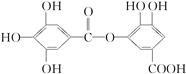 ,关于它的性质叙述中不正确的是( )
,关于它的性质叙述中不正确的是( )| A. | 酸性条件下可发生水解反应,且产物只有一种 | |
| B. | 1mol该有机物最多可跟8molNaOH反应 | |
| C. | 1mol该有机物最多可跟2molBr2反应 | |
| D. | 该有机物可跟NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠的电子式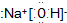 | |
| B. | 质子数为29、中子数为35的铜原子${:}_{29}^{35}$Cu | |
| C. | 氯离子的结构示意图: | |
| D. | 对苯二酚的结构简式: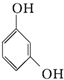 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁件表面镀铬时,铁件与外电源正极相连 | |
| B. | 反应CaO(s)+3C(s)═CaC2(s)+CO(g)在高温下能自发进行,则该反应的△H<0 | |
| C. | 用湿润的pH试纸测定0.1 mol•L-1的Na2CO3溶液的pH,其pH将偏大 | |
| D. | 已知(CH3CO)2O与水反应可生成乙酸(△H<0),向0.1 mol•L-1的乙酸溶液中加入少量(CH3CO)2O,溶液的pH和乙酸的电离程度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:3 | B. | 4:1 | C. | 2:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 112mL | B. | 224mL | C. | 336mL | D. | 500mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com