
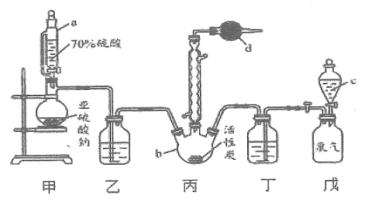
【题目】硫酰氯(![]() )是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:
)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:
已知:①![]() ,
,![]()
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
(1)仪器c的名称为_____,与c相比,仪器a的优点是__________。
(2)装置乙和丁中所装的试剂为_________________。
(3)球形冷凝管的作用___________________。
A.导气、冷凝回流 B.有利于平衡正向移动 C.防倒吸
(4)仪器d的作用为______________________。
(5)氯磺酸(![]() )加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________________________。
)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________________________。
(6)当装置戊中排出氯气![]() (已折算成标准状况)时,最终得到
(已折算成标准状况)时,最终得到![]() 纯净的硫酰氯,则硫酰氯的产率为____________。(保留三位有效数字)
纯净的硫酰氯,则硫酰氯的产率为____________。(保留三位有效数字)
(7)长期存放的硫酰氯会发黄,其原因可能为___________________。
【答案】分液漏斗 平衡分液漏斗内外压强,便于液体顺利流下 浓硫酸 AB 吸收SO2、Cl2等尾气,防止污染空气;同时防止空气中的水蒸气进入装置内 2ClSO3H![]() SO2Cl2+H2SO4 33.3% SO2Cl2中溶有其分解产生的Cl2
SO2Cl2+H2SO4 33.3% SO2Cl2中溶有其分解产生的Cl2
【解析】
从图中可以看出,丙装置内发生反应:![]() ,则甲装置制取SO2气体,戊装置提供Cl2。因为硫酰氯常温下在潮湿空气中易“发烟”,所以SO2、Cl2进入丙装置前都需干燥,乙、丁装置为气体的干燥装置,内盛液体应为浓硫酸。在丙装置内发生SO2与Cl2的可逆反应,因反应放热,生成的SO2Cl2易气化,所以需冷凝回流,未反应的SO2、Cl2需进行处理,以防污染空气;由于在潮湿空气中易“发烟”,所以d装置还需防止空气中的水蒸气进入丙装置内。
,则甲装置制取SO2气体,戊装置提供Cl2。因为硫酰氯常温下在潮湿空气中易“发烟”,所以SO2、Cl2进入丙装置前都需干燥,乙、丁装置为气体的干燥装置,内盛液体应为浓硫酸。在丙装置内发生SO2与Cl2的可逆反应,因反应放热,生成的SO2Cl2易气化,所以需冷凝回流,未反应的SO2、Cl2需进行处理,以防污染空气;由于在潮湿空气中易“发烟”,所以d装置还需防止空气中的水蒸气进入丙装置内。
(1)仪器c的名称为分液漏斗,与c相比,仪器a中存在稳压导管,其优点是平衡分液漏斗内外压强,便于液体顺利流下。答案为:分液漏斗;平衡分液漏斗内外压强,便于液体顺利流下;
(2)由以上分析知,装置乙和丁中所装的试剂为浓硫酸。答案为:浓硫酸;
(3)球形冷凝管既可将产物冷凝回流,又有利于平衡正向移动,其作用为AB。答案为:AB;
(4)仪器d的作用为吸收SO2、Cl2等尾气,防止污染空气;同时防止空气中的水蒸气进入装置内。答案为:吸收SO2、Cl2等尾气,防止污染空气;同时防止空气中的水蒸气进入装置内;
(5)氯磺酸(![]() )加热分解,能制得硫酰氯,同时生成硫酸,该反应的化学方程式为2ClSO3H
)加热分解,能制得硫酰氯,同时生成硫酸,该反应的化学方程式为2ClSO3H![]() SO2Cl2+H2SO4。答案为:2ClSO3H
SO2Cl2+H2SO4。答案为:2ClSO3H![]() SO2Cl2+H2SO4;
SO2Cl2+H2SO4;
(6)n(Cl2)=![]() =0.005mol,依据反应式
=0.005mol,依据反应式![]() ,生成SO2Cl20.005mol,则硫酰氯的产率为
,生成SO2Cl20.005mol,则硫酰氯的产率为![]() =33.3%。答案为:33.3%;
=33.3%。答案为:33.3%;
(7)信息③告诉我们:100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气(黄绿色)。所以长期存放的硫酰氯会发黄,其原因可能为SO2Cl2中溶有其分解产生的Cl2。答案为:SO2Cl2中溶有其分解产生的Cl2。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】下列事实不属于盐类水解应用的是( )
A.明矾、氯化铁晶体常用于净水
B.实验室通常在HCl气氛中加热MgCl2·6H2O制MgCl2
C.实验室配制FeCl3溶液时加入少量稀盐酸
D.实验室制氢气时加入CuSO4可加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列元素或化合物的性质变化顺序正确的是__________________
A.第一电离能:Cl>S>P>Si
B.共价键的极性:HF>HCl>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI
D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
(2)FeCl3 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 FeCl3 的结构式为_________,其中 Fe 的配位数为___________________
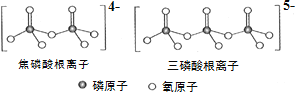
(3)NH4H2PO4 中,电负性最高的元素是________;P的________________杂化轨道与 O的2p轨道形成______键。NH4H2PO4 和 LiFePO4 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐, 如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示。这类磷酸根离子的化学式可用通式表示为 ______________(用 n 代表 P 原子数)。
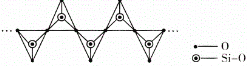
(4)高温高压下 CO2 的晶体结构与SiO2 相似,该晶体熔点比 SiO2 晶体____________(填“高”或“低”)。硅酸盐和 SiO2 一样,都是以硅氧四面体作为基本结构单元,图中表示一种含 n 个硅原子的单链式多硅酸根的结构(投影如图),Si 原子的杂化类型为_______________,其化学通式可表示为____________________
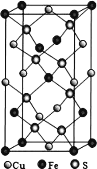
(5)四方晶系 CuFeS2 晶胞结构如图所示(下一页)。Cu2+的配位数为_______________,S2-的配位数为__已知:a=b=0.524 nm,c=1.032 nm,NA 为阿伏加德罗常数的值,CuFeS2晶体的密度是_________________ gcm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有KOH标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)B→__→__→__→__→F。
(2)上述(B)操作的目的是___。
(3)判断滴定到达终点的现象是___。
(4)若滴定开始和结束时,碱式滴定管中的液面如图所示,则起始读数为__mL,终点读数为___mL;所测盐酸溶液的浓度为___mol/L。

(5)若滴定终点读数时,俯视滴定管的刻度,其他操作均正确,则对滴定结果产生的影响是__。若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是___。(填“偏高”、“偏低”、或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示,下列叙述正确的是( )
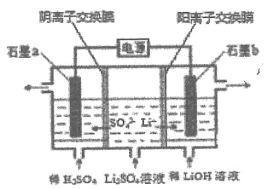
A.![]() 极附近溶液的
极附近溶液的![]() 增大
增大
B.![]() 极发生的反应为
极发生的反应为![]()
C.该法制备![]() 还可得到硫酸、氢气和氧气
还可得到硫酸、氢气和氧气
D.当电路中通过![]() 电子时,可得到
电子时,可得到![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为某同学设计的检验浓硫酸和碳反应所得气体产物的实验装置图。下列说法正确的是

A. 若按①→③→②顺序连接,可检验所有气体产物
B. 若装置②只保留a、b,同样可以达到实验目的
C. 若圆底绕瓶内碳粉过量,充分反应后恢复到25℃,溶液的pH≥5.6
D. 实验结束后,应按从下往上、从左往右的顺序拆卸装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水CoCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水CoCl2,故常在实验室中用作吸湿剂和空气湿度指示剂。
CoCl2+xH2O![]() CoCl2·xH2O
CoCl2·xH2O
深蓝色 粉红色
现有65 g无水CoCl2,吸水后变成CoCl2·xH2O 119 g。
(1)水合物中x=________。
(2)若该化合物中Co2+配位数为6,而且经定量测定得知内界和外界占有Cl-的个数比为1∶1,则其化学式可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过石油裂解可以获得乙烯,再以乙烯为原料还可以合成很多的化工产品,已知D有香味,试根据如图回答有关问题:
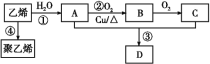
(1)有机物B的名称为____;A、C的官能团名称分别是____和____;聚乙烯的结构简式为_____________。
(2)写出图示中①、②、③反应的化学方程式,并指明反应类型:
①_____;反应类型:______。
②______;反应类型:______。
③_______;反应类型:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com