
实验室可用冰醋酸(CH3COOH)和异戊醇(![]() )合成乙酸异戊酯,其实验装置如图所示,操作过程如下:
)合成乙酸异戊酯,其实验装置如图所示,操作过程如下:
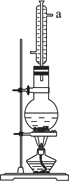
①向圆底烧瓶中加入几粒碎瓷片,先后注入15 mL(0.14 mol)异戊醇和20 mL(0.35 mol)冰醋酸,最后小心加入5 mL浓H2SO4,振荡使其不再分层.
②在烧瓶上安装水冷凝管,连好上、下水,后加热装置1 h冷却至室温.
③把烧瓶内混合液倒入盛有饱和Na2CO3溶液的锥形瓶中,振荡后静置.
④把③中水层分离出后,再用蒸馏水洗涤有机层几次,并将洗涤后水层分离出.
⑤将分离的有机层转移到另一锥形瓶中,加入无水MgSO4或Mg(NO3)2处理.最后将处理后的有机层经135-143℃蒸馏,即得乙酸异戊酯产品.
试完成以下问题:
(1)写出乙酸和异戊醇合成乙酸异戊酯的化学方程式________,其中浓H2SO4的作用是________,烧瓶内碎瓷片的作用是________.
(2)水冷凝器的作用是________,冷凝管的a口是冷却水的________(填“进口”“出口”).
(3)乙酸和异戊醇物质的量之比0.35∶0.14大于1∶1,其原因是________.
(4)③中饱和碳酸钠的作用是________;⑤中无水MgSO4或Mg(NO3)2的作用是________.
(5)步骤③的操作应用________(填仪器名称),洗涤分离出水层后,应怎样把有机层转移至锥形瓶里________.
|
答案:(1) 催化剂和脱水剂 防止液体暴沸 (2)冷凝回流 出口 (3)因该反应是可逆反应,增大廉价的乙酸的量,可以提高异戊醇的转化率 (4)洗涤乙酸异戊酯中的H2SO4和过量的CH3COOH 吸收乙酸异戊酯中残留的水 (5)分液漏斗 应将有机层从分液漏斗的上口处倒出 解析:此题是有关有机物制备的实验题.题中完整地给出乙酸异戊酯的合成过程,且设问中的5个小题都是围绕着实验原理和操作方法提出的.表面上考查的是合成乙酸异戊酯的实验内容,但实质上还是考查中学制备乙酸乙酯的实验,当然,试题中的装置和操作又与中学的乙酸乙酯实验有所不同,即增加了对冷凝管、分液漏斗的使用的考查.这将有助于提高学生的信息迁移能力,同时提高他们分析和解决问题的能力. (1)酯化反应的实质是羧酸脱羟基、醇脱氢结合成水的取代反应,其中浓硫酸在反应中起催化剂和脱水剂的作用,为了防止在加热过程中液体暴沸,预先在烧瓶中加入碎瓷片. (2)酯化反应的进行是需要加热的,但其反应物冰醋酸和异戊醇及其生成物乙酸异戊酯都属于低沸点物质,故在反应过程中极易形成蒸气逸出,为了使反应物充分利用,常用冷凝管使蒸气冷凝回流.使用冷凝管时要注意水流方向,即水流方向应与被冷却气体的流向相反,即图中的a口应是出水方向. (3)从乙酸与异戊醇的反应方程式: 可以看出,乙酸与异戊醇是按1∶1的方式消耗的,但由于该反应是可逆反应,为了提高成本较高的异戊醇的转化率,常使廉价的乙酸过量. (4)反应完毕后,烧瓶中的混合液中含有H2SO4、乙酸、异戊醇、乙酸异戊酯、水等物质,倒入饱和Na2CO3溶液中后,混合液中的H2SO4和过量的乙酸将与Na2CO3反应而最后位于水层,有机层主要是乙酸异戊酯和异戊醇,另有少量的水,蒸馏可使乙酸异戊酯和异戊醇分离,蒸馏时加入MgSO4或Mg(NO3)2可吸收有机层中的水分〔可联想工业制浓HNO3时加Mg(NO3)2吸水〕. (5)③中所得分层后的混合物,用分液漏斗进行分离,使用分液漏斗分液时要注意:下层液体从分液漏斗的下端流出,上层液体应从分液漏斗的上口处倒出. |


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(SO32-) |
| n(HSO3-) |
|
91:9 | 1:1 | 9:91 | ||
| 室温下pH | 8.2 | 7.2 | 6.2 |
| n(SO32-) |
| n(HSO3-) |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇区高三上学期期末(一模)考试化学试卷(解析版) 题型:填空题
硫元素的含氧酸盐在工业上用途广泛,完成下列填空。
工业上用Na2SO3溶液处理工业尾气中的SO2,下表数据表示反应过程中 随pH变化的关系:
随pH变化的关系:
|
|
91:9 |
1:1 |
9:91 |
|
室温下pH |
8.2 |
7.2 |
6.2 |
(1)简述 = 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
= 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
c (HSO3-) + 2c (SO32-) = _______ mol/L 。
(2)已知:Ki1(H2SO3)> Ki(HAc) > Ki2(H2SO3) > Ki2(H2CO3),要使NaHSO3溶液中c(Na+):c(HSO3-)接近1:1,可在溶液中加入少量____________。
a.H2SO3溶液 b.NaOH溶液 c.冰醋酸 d.Na2CO3
(3)实验室通过低温电解KHSO4溶液制备过二硫酸钾K2S2O8,写出熔融KHSO4的电离方程式:__________________________________________。
(4)S2O82-有强氧化性,还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。书写此反应的化学方程式: 。
(5)已知:S2O32-有较强的还原性,实验室可用I-测定K2S2O8样品的纯度:反应方程式为:
S2O82-+2I-→2SO42-+I2 ……① I2+2S2O32-→2I-+S4O62- ……②
S2O82-、S4O62-、I2氧化性强弱顺序:__________________________。
(6)K2S2O8是偏氟乙烯(CH2=CF2)聚合的引发剂,偏氟乙烯由CH3—CClF2气体脱去HCl制得,生成0.5 mol偏氟乙烯气体要吸收54 kJ的热,写出反应的热化学方程式_______。
查看答案和解析>>
科目:高中化学 来源:2014届湖北省新高三起点调研化学试卷(解析版) 题型:实验题
实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等。

下列装置分别是产品的合成装置和精制装置示意图:

合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2 mL环己醇和25 mL冰醋酸。开动搅拌器,将40 mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5 min。然后,在室温下继续搅拌30 min后,在合成装置中再加入30 mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。
回答下列问题:
(1)在合成装置中,甲装置的名称是 。
(2)三颈烧瓶的容量为 (填“50 mL"、“100 mL”或“250 mL")。
(3)滴液漏斗具有特殊的结构,主要目的是____ 。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是 。然后加入精制食盐使之变成饱和溶液,将混合液倒人____ 中,分离得到有机层。
(5)用如上右图对粗产品进行精制,蒸馏收集____ ℃的馏分。
(6)检验坏己酮是否纯净,可使用的试剂为____ 。
A.重铬酸钾溶液 B.金属钠 C.新制的氢氧化铜悬浊液
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省毕业班质量检查理综考试化学试卷(解析版) 题型:计算题
利用反应I2(s)+Cl2(g)=2ICl(l),实验室可用如下图所示装置(加热、夹持仪器已略去)制取少量IC1。

已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:
ICl(l)+Cl2(g)=2ICl3(l)
(1)装置A中发生反应的化学方程式是____________。
(2)装置B的作用是______。不能用装置F代替装置E,理由是____________。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是______ (填标号)。
A.过滤 B.蒸发结晶 C.蒸馏 D.分液
(4)用ICl的冰醋酸溶液测定某油脂的不饱和度。进行如下两个实验,实验过程中有关反应为:
i.
ii.ICl+KI=I2+KCl
iii.I2+2Na2S2O3=2NaI+Na2S4O6
实验1:将0.500g该油脂样品溶于10mL四氯化碳后,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol•L—1的Na2S2O3,标准溶液滴定。经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL。
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL。
①滴定过程中可用______作指示剂。
②滴定过程中需要不断振荡,否则会导致V1______(填“偏大”或“偏小”)。
③0.500g该油脂样品所消耗的ICl的物质的量为______mol。由此数据经换算即可求得该油脂的不饱和度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com