
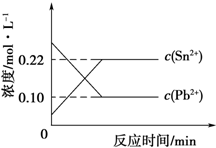
 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入少量 Sn(NO3)2固体后,c(Pb2+)变大 | |
| C. | 往平衡体系中加入少量金属铅后,c(Pb2+)增大 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H<0 |
分析 A.由图可知,平衡时c(Pb2+)=0.1mol/L,c(Sn2+)=0.22mol/L,代入平衡常数表达式K=$\frac{c(S{n}^{2+})}{c(P{b}^{2+})}$计算;
B.加入少量Sn(NO3)2固体,溶解Sn2+浓度增大,平衡向逆反应移动;
C.金属铅是固体,不影响平衡移动;
D.升高温度,平衡体系中c(Pb2+)增大,说明平衡向逆反应进行.
解答 解:A.由图可知,平衡时c(Pb2+)=0.1mol/L,c(Sn2+)=0.22mol/L,故该温度下反应的平衡常数K=$\frac{c(S{n}^{2+})}{c(P{b}^{2+})}$=$\frac{0.22}{0.1}$=2.2,故A正确;
B.加入少量Sn(NO3)2固体,溶液中Sn2+浓度增大,平衡向逆反应移动,c(Pb2+)增大,故B正确;
C.金属铅是固体,增大铅的用量,不影响平衡移动,c(Pb2+)不变,故C错误;
D.升高温度,平衡体系中c(Pb2+)增大,说明平衡向逆反应进行,升高温度平衡向吸热反应移动,故正反应为放热反应,故D正确,
故选C.
点评 本题考查影响化学平衡的因素、化学平衡图象、化学平衡常数的计算等,难度中等,是对基础知识的考查,注意B选项中Sn(NO3)2为可溶性固体.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 .
. ,A2C的结构式:H-O-H.
,A2C的结构式:H-O-H. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | 原子半径最小 |
| B | 核外3个能级上的电子数相等 |
| C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
| D | 2p轨道上成对电子数与未成对电子数相等 |
| E | N层电子数为1,内层轨道全部排满电子 |
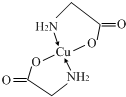 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴离子数和阳离子数 | |
| B. | 阳离子的正电荷总数和阴离子的负电荷总数 | |
| C. | 阴、阳离子的质量 | |
| D. | 每个阳离子与每个阴离子所带的电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )
I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )| A. | 反应I2(aq)+I-(aq)═I3- (aq)的△H>0 | |
| B. | 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2 | |
| C. | 若反应进行到状态D时,一定有v正>v逆 | |
| D. | 状态A与状态B相比,状态A的c(I2) 小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 用锡焊接的铁质器件,焊接处易生锈 | |
| C. | 水库的钢闸门连电源正极不易被腐蚀 | |
| D. | 轮船船体镶嵌锌块,船体不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:1 | C. | 2:3 | D. | 1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com