
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b)-58.7 | I2-184.0 |
| ③ | (e)-19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O-100.0 | H2S-60.0 | (d)-42 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
| A. | a、b、c的化学式分别为Ne2、Br2、HF | |
| B. | 第②组物质均有氧化性;第③组物质对应水溶液均是强酸 | |
| C. | 第④组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te | |
| D. | 上表中同族物质对应的氢化物的沸点,均随相对分子质量的增大而升高 |
分析 稀有气体是单原子分子;卤素包括F、Cl、Br、I,单质具有氧化性,它们氢化物对应水溶液中HF酸不是强酸;第ⅥA元素包括O、S、Se、Te,同主族元素氢化物稳定性从上到下逐渐减弱;第ⅣA元素包括C、Si、Ge、Sn,该族物质对应的氢化物的沸点,均随相对分子质量的增大而升高,但是O、F元素对应的氢化物分子间存在氢键,所以它们的沸点是同主族中最高的.
解答 解:A、a、b、c的化学式分别为Ne、Br2、HF,故A错误;
B、第②组物质是卤素单质,均有氧化性;第③组物质对应水溶液中HF酸不是强酸,故B错误;
C、第ⅥA元素包括O、S、Se、Te,同主族元素氢化物稳定性从上到下逐渐减弱,即第④组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te,故C正确;
D、分子晶体对应的氢化物的沸点,均随相对分子质量的增大而升高,但是O、F元素对应的氢化物分子间存在氢键,所以它们的沸点是同主族中最高的,故D错误.
故选C.
点评 本题考查较为综合,题目难度中等,本体注意元素周期律的递变规律以及氢键的构成、性质.


科目:高中化学 来源: 题型:选择题

| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-242kJ•mol-1 | |
| B. | 若H-H、O═O的键能分别是436 kJ•mol-1和496 kJ•mol-1,则H-O的键能是463 kJ•mol-1 | |
| C. | 据图可知,氢气的燃烧热为242 kJ•mol-1 | |
| D. | 10克氢气在氧气中完全燃烧,放出热量为1210kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-C | C-H | H-H | C-O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 463 |
| A. | 1550+43.2kJ•mol-1 | B. | 750-43.2kJ•mol-1 | ||
| C. | 1550+86.4kJ•mol-1 | D. | 750+43.2kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
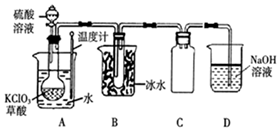 二氧化氯(ClO2)被联合国世界卫生组织(WHO)列为AⅠ级高效安全灭菌消毒剂.常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不与水反应.温度过高,二氧化氯的水溶液可能爆炸.某研究性学习小组拟用图所示装置制取并收集ClO2.(加热和夹持装置均省略)
二氧化氯(ClO2)被联合国世界卫生组织(WHO)列为AⅠ级高效安全灭菌消毒剂.常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不与水反应.温度过高,二氧化氯的水溶液可能爆炸.某研究性学习小组拟用图所示装置制取并收集ClO2.(加热和夹持装置均省略)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
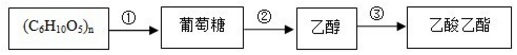
| A. | 反应②的反应类型属于分解反应 | |
| B. | (C6H10O5)n可以是淀粉或纤维素,二者互为同分异构体 | |
| C. | 将烧黑的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯和丙烯的混合物中所含碳碳双键的数目为NA | |
| B. | 1L0.5mol•L-1Na2CO3溶液中阴离子的总数为0.5NA | |
| C. | 标准状况下,11.2L H2和D2的混合气体中所含的质子数为NA | |
| D. | 向大量水中通入1mol氯气,反应中转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
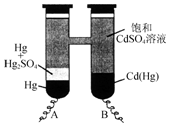 依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )
依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )| A. | 电池工作时Cd2+向电极B移动 | |
| B. | 电极A上发生的反应:Hg2SO4+2e-═2Hg+SO42- | |
| C. | 电极B上发生的反应:Cd(Hg)-4e-═Hg2++Cd2+ | |
| D. | 反应中每生成a mol Hg转移3a mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
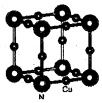 配合物[Cu(CH3C≡N)4]BF4是双烯合成反应的催化剂,它被浓硝酸分解的化学方程式为:[Cu(CH3C≡N)4]BF4$\stackrel{HNO_{3}}{→}$Cu2++H3BO3+CO2↑+HF…(未配平).
配合物[Cu(CH3C≡N)4]BF4是双烯合成反应的催化剂,它被浓硝酸分解的化学方程式为:[Cu(CH3C≡N)4]BF4$\stackrel{HNO_{3}}{→}$Cu2++H3BO3+CO2↑+HF…(未配平).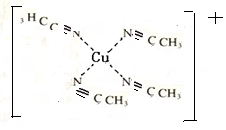 (不考虑空间构型).
(不考虑空间构型).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物都是碱性氧化物 | B. | 氢氧化物都是白色固体 | ||
| C. | 单质都可以与水反应 | D. | 单质在空气中都形成致密氧化膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com