
| A. | 30 g由14C2H2和C18O组成的混合气体中含有的质子数为14NA | |
| B. | 1 mol H2与1 mol I2 (g)混合后充分反应生成的HI分子数为2NA | |
| C. | 1 mol乙醇经催化氧化生成乙醛后转移的电子数为4NA | |
| D. | 25℃时,100 mL pH=2的新制氯水中:N(OH-)+N(ClO-)+N(HClO)=0.001NA |
分析 A、14C2H2和C18O的摩尔质量均为30g/mol,且两者均含有14个质子;
B、氢气和碘的反应为可逆反应;
C、1mol乙醇催化氧化为乙醛时消耗0.5mol氧气,而氧气反应后由0价变为-2价;
D、在pH=2的氯水中,c(H+)=10-2mol/L,而n(OH-)+n(ClO-)+n(Cl-)=n(H+).
解答 解:A、14C2H2和C18O的摩尔质量均为30g/mol,故30g混合物的物质的量为1mol,且两者均含有14个质子,故1mol混合物中含有14NA个质子,故A正确;
B、氢气和碘的反应为可逆反应,不能进行彻底,故生成的HI分子个数小于2NA个,故B错误;
C、1mol乙醇催化氧化为乙醛时消耗0.5mol氧气,而氧气反应后由0价变为-2价,故0.5mol氧气转移2NA个电子,故C错误;
D、在pH=2的氯水中,c(H+)=10-2mol/L,100mL溶液中n(H+)=10-2mol/L×0.1L=10-3mol,而n(OH-)+n(ClO-)+n(Cl-)=n(H+)=10-3mol,但由于n(Cl-)≠n(HClO),故n(OH-)+n(ClO-)+n(HClO)≠10-3mol,即N(OH-)+N(ClO-)+N(HClO)≠0.001NA,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1的碳酸钠溶液中存在5种微粒,且c(CO32-)+c(HCO3-)=0.1mol•L-1 | |
| B. | 硫化钠水解的离子方程式:S2-+2H2O?H2S+2OH- | |
| C. | FeSO4溶液中滴加次氯酸钠溶液:Fe2++ClO-+2H2O=Fe(OH)2↓+2HClO | |
| D. | AgNO3溶液中滴加足量NaCl溶液,再滴加NaI溶液,先产生白色沉淀后转化为黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
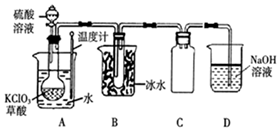 二氧化氯(ClO2)被联合国世界卫生组织(WHO)列为AⅠ级高效安全灭菌消毒剂.常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不与水反应.温度过高,二氧化氯的水溶液可能爆炸.某研究性学习小组拟用图所示装置制取并收集ClO2.(加热和夹持装置均省略)
二氧化氯(ClO2)被联合国世界卫生组织(WHO)列为AⅠ级高效安全灭菌消毒剂.常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不与水反应.温度过高,二氧化氯的水溶液可能爆炸.某研究性学习小组拟用图所示装置制取并收集ClO2.(加热和夹持装置均省略)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯和丙烯的混合物中所含碳碳双键的数目为NA | |
| B. | 1L0.5mol•L-1Na2CO3溶液中阴离子的总数为0.5NA | |
| C. | 标准状况下,11.2L H2和D2的混合气体中所含的质子数为NA | |
| D. | 向大量水中通入1mol氯气,反应中转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
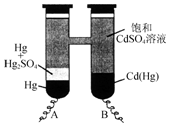 依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )
依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )| A. | 电池工作时Cd2+向电极B移动 | |
| B. | 电极A上发生的反应:Hg2SO4+2e-═2Hg+SO42- | |
| C. | 电极B上发生的反应:Cd(Hg)-4e-═Hg2++Cd2+ | |
| D. | 反应中每生成a mol Hg转移3a mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 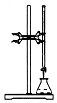 用标准氢氧化钠溶液滴定未知浓度的盐酸 | |
| B. | 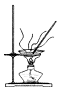 加热FeCl3溶液获取FeCl3固体 | |
| C. | 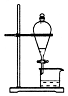 用酒精萃取碘水中的碘 | |
| D. | 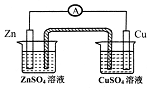 通过原电池原理证明金属性Zn>Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
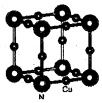 配合物[Cu(CH3C≡N)4]BF4是双烯合成反应的催化剂,它被浓硝酸分解的化学方程式为:[Cu(CH3C≡N)4]BF4$\stackrel{HNO_{3}}{→}$Cu2++H3BO3+CO2↑+HF…(未配平).
配合物[Cu(CH3C≡N)4]BF4是双烯合成反应的催化剂,它被浓硝酸分解的化学方程式为:[Cu(CH3C≡N)4]BF4$\stackrel{HNO_{3}}{→}$Cu2++H3BO3+CO2↑+HF…(未配平).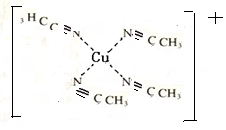 (不考虑空间构型).
(不考虑空间构型).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com