
【题目】取50.0 mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51 g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66 g,并有气体放出。试计算:
(1)写出Na2SO4的电离方程式;
(2)原混合溶液中Na2CO3和Na2SO4的物质的量浓度;
(3)产生的气体在标准状况下的体积
【答案】(1)Na2SO4===2Na++SO42-
(2)4.66 g为BaSO4的质量
n(BaSO4)=n(Na2SO4)=![]() =0.02 mol
=0.02 mol
c(Na2SO4)=![]() =0.4 mol·L-1
=0.4 mol·L-1
n(BaCO3)=n(Na2CO3)=![]() =0.05 mol
=0.05 mol
c(Na2CO3)=![]() =1.0 mol·L-1
=1.0 mol·L-1
答:Na2CO3的物质的量浓度为1.0 mol·L-1,Na2SO4的物质的量浓度为0.4 mol·L-1
(3)n(CO2)=n(Na2CO3)=0.05 mol,
V(CO2)=0.05 mol×22.4 L·mol-1=1.12 L。
答:二氧化碳的体积为1.12 L
【解析】(1)Na2SO4属于强电解质,电离方程式为Na2SO4=2Na++SO42-,故答案为:Na2SO4=2Na++SO42-;
(2)14.51克白色沉淀是BaCO3和BaSO4混合物,剩余沉淀为BaSO4,Na2SO4的物质的量等同于BaSO4的物质的量,所以Na2SO4的物质的量为: ![]() =0.02mol,所以Na2SO4物质的量的浓度为
=0.02mol,所以Na2SO4物质的量的浓度为![]() =0.4mol/L,减少的沉淀质量为BaCO3,Na2CO3的物质的量等同于BaCO3的物质的量,所以Na2CO3的物质的量为:
=0.4mol/L,减少的沉淀质量为BaCO3,Na2CO3的物质的量等同于BaCO3的物质的量,所以Na2CO3的物质的量为: ![]() =0.05mol,所以Na2CO3的物质的量浓度为
=0.05mol,所以Na2CO3的物质的量浓度为![]() =1mol/L,答:原混和溶液中Na2CO3和Na2SO4的物质的量浓度分别为:1mol/L、0.4mol/L;
=1mol/L,答:原混和溶液中Na2CO3和Na2SO4的物质的量浓度分别为:1mol/L、0.4mol/L;
(3)设生成的气体在标准状况下的体积为x,
BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑
1mol 22.4L
0.05mol x
![]() =
=![]() ,x=1.12L,答:产生的气体在标准状况下的体积为1.12L。
,x=1.12L,答:产生的气体在标准状况下的体积为1.12L。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:
【题目】Cr2O3是重要的化工原料。铬矿石的主要成分为Cr2O3,并含有一定量的FeO、SiO2等杂质,工业上生产Cr2O3的过程如图所示。

回答下列问题:
(1) 焙烧后的产物Na2CrO4中Cr的化合价为_____。
(2)滤液1用H2SO4酸化时发生反应的离子方程式为2CrCO42-+2H+=Cr2O72-+ H2O和_______,该过程不能用盐酸代替硫酸的理由是_______________。
(3)向滤液2中加蔗糖的目的是_________,滤液3中溶质的主要成分为_____(填化学式)。
(4)若向滤液2的饱和溶液中加入KCl固体,充分反应后可得货要的试剂K2Cr2O7。该反应能发生的原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应一定属于吸热反应的是
A.天然气的燃烧
B.盐酸与氢氧化钠溶液的反应
C.钠与水的反应
D.Ba(OH)2·8H2O 与 NH2Cl 固体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图所示的实验操作,不能达到相应的实验目的的是

A. 用甲除去CO气体中的CO2气体
B. 用乙分离沸点相差较大的互溶液体混合物
C. 丙向容量瓶中转移液体
D. 用丁分离互不相溶的两种液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)化学是一门以实验为基础的学科,化学所取得的丰硕成果与实验的重要作用分不开。结合下列实验装置图回答问题:

(1)写出上图中所示仪器的名称:①___;②___。
(2)若利用该装置分离乙酸(沸点118 ℃)和乙酸乙酯(沸点77.1 ℃)的混合物,还缺少的仪器有___,将仪器补充完整后进行的实验操作的名称为___;实验时仪器②中冷却水的进口为________(填“f”或“g”)。
(3)应用上述分离操作,首先得到的物质是________。
(4)蒸馏烧瓶内碎瓷片的作用是________________。
(Ⅱ)硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度是________mol·L-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol·L-1的稀硫酸,则配制稀硫酸时需要取________mL的该硫酸;配制时需选用的仪器主要有量筒、烧杯、玻璃棒、___、___(在横线上填写所缺仪器的名称)。
(3)配制过程中,下列操作会使配制的稀硫酸溶液浓度偏高的是___(填序号)。
①量取浓硫酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液并定容
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应时,下列措施不能使反应速率加快的是
A.加热B.不用铁片,改用铁粉
C.滴加少量的CuSO4溶液D.不用稀硫酸,改用98%浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程。 请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定.学习小组的同学设计了滴定的方法测定x值.
①称取2.520g纯草酸晶体,将其制成100.00mL水溶液为待测液。
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4.
③用浓度为0.1000molL-1 的KMnO4标准溶液进行滴定,达到终点时消耗20.00mL。
(1)滴定时,将酸性KMnO4标准液装在如图中的______(填“甲”或“乙”)滴定管中。
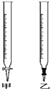
(2)本实验滴定达到终点的标志是________________;
(3)通过上述数据,求得x=______;
讨论:①若滴定终点时仰视滴定管刻度,则由此测得的x值会______(填“偏大”、“偏小”或“不变”,下同);
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x会__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 标准状况下,11.2L的戊烷所含的分子数为0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA
D. 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com