
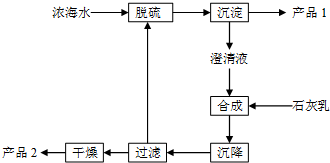
 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品. _.
_.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
分析 (1)涉及反应Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,Br元素化合价分别由0价变化为-1价、+5价,结合化合价的变化计算;
(2)①氯化钠是离子化合物,钠离子和氯离子形成离子键;
②纯净的饱和食盐水,利用溶解度的不同,向其中加入碳酸氢铵可制备碳酸氢钠.
③称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g,设碳酸氢钠物质的量为x,含氯化钠物质的量为y,
$\left\{\begin{array}{l}{84x+58.5y=a}\\{(x+y)×58.5=b}\end{array}\right.$,计算得到xy,碳酸氢钠的质量分数等于碳酸氢钠质量除以混合物总质量;
(3)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg(OH)2计算氢氧化镁的质量.
解答 解:(1)反应Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3中,Br元素化合价分别由0价变化为-1价、+5价,反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×$\frac{1}{1+5}$×5=$\frac{5}{3}$mol,
故答案为:$\frac{5}{3}$;
(2)①氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为 ,
,
故答案为: ;
;
②纯净的饱和食盐水,利用溶解度的不同,向其中加入碳酸氢铵可制备碳酸氢钠,反应的化学方程式为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl,
故答案为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl;
③量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,发生NaHCO3+HCl=NaCl+H2O+CO2↑,蒸干溶液后灼烧,剩余固体质量为b g,设碳酸氢钠物质的量为x,含氯化钠物质的量为y,依据元素守恒列式计算,$\left\{\begin{array}{l}{84x+58.5y=a}\\{(x+y)×58.5=b}\end{array}\right.$
x=$\frac{a-b}{25.5}$mol,
样品碳酸氢钠的质量分数=$\frac{\frac{a-b}{25.5}mol×84g/mol}{ag}$×100%=$\frac{84(a-b)}{25.5a}$×100%,
故答案为:$\frac{84(a-b)}{25.5a}$×100%;
(3)采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×$\frac{58g}{24g}$=69.6g,
故答案为:Mg(OH)2;69.6.
点评 本题考查了物质性质的分析应用,为高考常见题型,侧重于学生的分析、实验和计算能力的考查,注意把握实验的原理以及物质的性质,从质量守恒的角度把握相关方程式的计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铁片粉与稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 氧化亚铁粉末溶于盐酸中:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 铜与氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 向硫酸铝溶液中加入过量氨水:Al3++4OH-═AlO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑤ | C. | ①③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 小苏打用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 计算机芯片所用的材料是高纯度的硅 | |
| D. | 纯净的二氧化硅是生产光纤制品的基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①③④⑤ | C. | ③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (I)研究CO2的利用对促进低碳社会的构建具有重要的意义.将CO2与焦炭作用生成CO,CO可用于炼铁等.
(I)研究CO2的利用对促进低碳社会的构建具有重要的意义.将CO2与焦炭作用生成CO,CO可用于炼铁等.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com