
| A. | 检验鸡蛋壳能否溶解在酸中 | B. | 检验食盐中是否加碘 | ||
| C. | 除去热水瓶内壁上的水垢 | D. | 鉴别食盐和纯碱 |
分析 A.碳酸钙能与醋酸反应;
B.食盐中为碘酸钾,遇淀粉不变蓝;
C.水垢的成分为碳酸钙,与食醋反应;
D.纯碱与食醋反应生成气体,而NaCl不能.
解答 解:A.碳酸钙能与醋酸反应,则可检验鸡蛋壳能否溶解在酸中,可完成,故A正确;
B.食盐中为碘酸钾,遇淀粉不变蓝,缺少还原性物质,不能完成,故B错误;
C.水垢的成分为碳酸钙,与食醋反应,则可利用食醋除去热水瓶内壁上的水垢,故C正确;
D.纯碱与食醋反应生成气体,而NaCl不能,则利用食醋可鉴别,故D正确;
故选B.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应温度/℃ | 反应时间(min) | 收率 |
| 30~35 | 180 | 10.0 |
| 20~25 | 60 | 18.0 |
| 20~25 | 120 | 26.0 |
| 20~25 | 180 | 58.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加N2的量,可以加快反应速率 | |
| B. | 当N2和H2全部转化为NH3时,反应才达到最大限度 | |
| C. | 达到平衡时,H2和NH3的浓度比一定为3:2 | |
| D. | 分别用N2和NH3来表示该反应的速率时,数值大小相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等.下列判断错误的是( )| A. | 原子半径:B>C>A | |
| B. | 最高价氧化物对应水化物的酸性:C<D | |
| C. | 含B元素的盐溶液一定显酸性 | |
| D. | 最简单气态氢化物的热稳定性:A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物稳定性:Y>Z | |
| B. | XW3与WZ相遇,产生大量白烟 | |
| C. | 氧化物的水化物的酸性:Y<Z | |
| D. | X与Z不能同时存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素的通式都是(C6H10O5)n,是同分异构体 | |
| B. | 向鸡蛋清溶液中加入(NH4)2SO4饱和溶液,有沉淀析出,再加水沉淀不溶解 | |
| C. | 油脂、糖类和蛋白质是食物含有的主要营养物质,它们都是高分子化合物 | |
| D. | 可以用新制的Cu(OH)2悬浊液检验患者的尿液中是否含糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
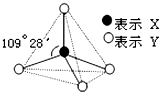 甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同.
甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组用图一所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用图一所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com