
元素周期表是一座开放的“元素大厦”,40号元素在元素周期表中的位置是()
A. 第四周期第ⅡA族 B. 第五周期第ⅣB族
C. 第五周期第IVA族 D. 第五周期第ⅡA族
科目:高中化学 来源: 题型:
某温度下,反应H2(g)+I2(g)⇌2HI(g)△H<0,在带有活塞的密闭容器中达到平衡,下列说法中正确的是()
A. 容器体积不变,升温正反应速率减小
B. 温度、压强均不变,充入HI气体,开始时正反应速率增大
C. 温度不变,压缩气体的体积,平衡不移动,颜色加深
D. 容器体积、温度不变,充入氦气后,正反应速率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中正确的是()
A. 从组成元素上可以区别纯净物和混合物
B. 往Fe(OH)3胶体中逐滴加入稀硫酸会产生沉淀而后沉淀逐渐溶解
C. 通过化学变化可以实现16O与18O问的相互转化
D. 鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各实验装置的叙述中,不正确的是()
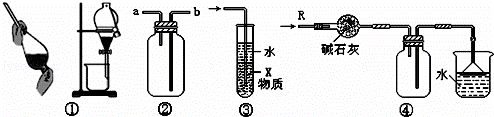
A. 装置①可用于分离C2H5OH和H2O的混合物
B. 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D. 装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,首先观察到溶液变红的区域是()
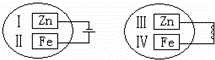
A. Ⅰ和Ⅲ附近 B. Ⅰ和Ⅳ附近 C. Ⅱ和Ⅲ附近 D. Ⅱ和Ⅳ附近
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 工业上电解熔融的Al2O3冶炼铝用铁做阳极
B. 用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2
C. 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH
D. 用惰性电极电解浓CuSO4溶液一小段时间后,加入Cu2O固体可以使CuSO4溶液恢复原来浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了变废为宝,拟采用铅铬黄法对某电镀厂含铬废水进行处理,并生产出符合条件的铅铬黄(PbCrO4).设计实验如下:
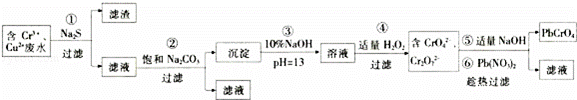
已知:a.该厂的废水中主要含Cr3+,还有少量Cu2+和其它可溶性杂质;
b.Cr(OH)3不溶于水,具有两性,pH=13时,发生反应:Cr(OH3)+OH﹣=﹣
回答下列问题:
(1)滤渣的成分是 (填化学式);第②步加入Na2CO3溶液的作用是 .
(2)第④步生成CrO42﹣的离子方程式为 .
(3)第⑤步加入NaOH的目的是为了提高铅铬黄的产率,请用化学平衡移动原理加以解释: .
(4)测定铅铬黄纯度:取mg铅铬黄样品溶解,加足量KI将其还原为Cr3+,再用 c mol•L﹣1 Na2S2O3标准液滴定(反应:2Na2S2O3+I2=Na2S4O6+2NaI),消耗体积VmL.该滴定实验中所需主要玻璃仪器有烧杯、 ,测定标准液体积的仪器事先进行洗涤所用试剂依次为 ;此铅铬黄样品的质量分数w=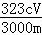 (用含c、m和V的式子表示).
(用含c、m和V的式子表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H﹣H键的键能为436kJ/mol,O═O键的键能为498kJ/mol,根据热化学方程式H2(g)+ O2(g)═H2O(l)△H=﹣286kJ/mol,判断H2O分子中O﹣H键的键能为()
O2(g)═H2O(l)△H=﹣286kJ/mol,判断H2O分子中O﹣H键的键能为()
A. 485.5 kJ/mol B. 610 kJ/mol C. 917 kJ/mol D. 1 220 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com