
| A. | 原子核外电子数为3 | B. | 相对原子质量为2 | ||
| C. | 原子的核电荷数为3 | D. | 原子结构示意图为  |
分析 由题意可知,“氦(He-3),其原子核中质子数为2、中子数为1”,结合“原子序数=核内质子数=核外电子数=核电荷数”和“相对原子质量≈质子数+中子数(近似整数值)”据此进行解答.
解答 解:A.原子核外电子数=核内质子数=2,故A错误;
B.相对原子质量≈质子数+中子数=1+2=3,故B错误;
C.He原子的核电荷数=质子数=2,故C错误;
D.He的核电荷数=核外电子总数=2,其原子结构示意图为: ,故D正确;
,故D正确;
故选D.
点评 本题考查原子构成,题目难度不大,注意了解原子的定义和构成,了解核外电子在化学反应中的作用;掌握原子结构示意图与离子结构示意图的区别、特点,掌握相对原子质量的概念及其计算方法.


科目:高中化学 来源: 题型:选择题
| A. | a+m=b-n | B. | a+b=m+n | C. | a-m=b+n | D. | a+m=b-n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
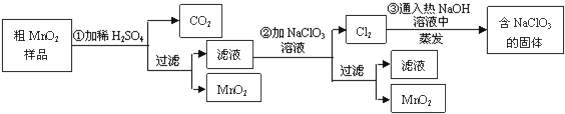
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
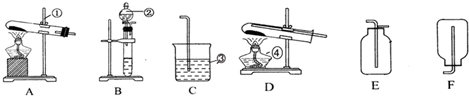
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间 | 开始 | 8h后 | 16h 后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
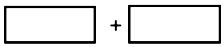 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>E>D | B. | A>B>D>E | C. | D>A>B>E | D. | D>E>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
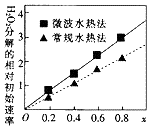 钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com