
为了合理 利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得:5 g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量 。试写出甲醇燃烧的热化学方程式:_______________________________________________________。
。试写出甲醇燃烧的热化学方程式:_______________________________________________________。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形 成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
成过程。在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
| 化学键 | H—H | N—H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2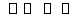 2NH3 ΔH=a kJ·mol-1。
2NH3 ΔH=a kJ·mol-1。
试根据表中所列键能数据计算a的数值(列出简单的计算式):________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)===CO2(g)
ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l)
ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH3=-2 599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变(列出简单的计算式):
__________________________________________________。
科目:高中化学 来源: 题型:
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
①C、CO ②AlCl3、Al(OH)3 ③N2、NO ④S、SO2 ⑤NaOH、Na2CO3
A.①②⑤ B.②③⑤
C.③④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
在298 K、100 kPa时,已知:
2H2O(g)===2H2(g)+O2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是 ( )。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) 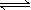 CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) 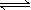 CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
⑴反应Ⅰ能自发进行的条件是 。
⑵对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp= (用表达式表示)。
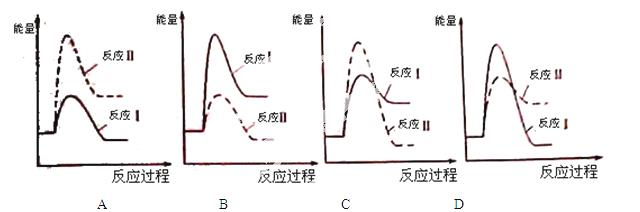
⑶假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
⑷通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是 。
⑸图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有 。
A.向该反应体系中投入石灰石
B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
⑹恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,则下,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。
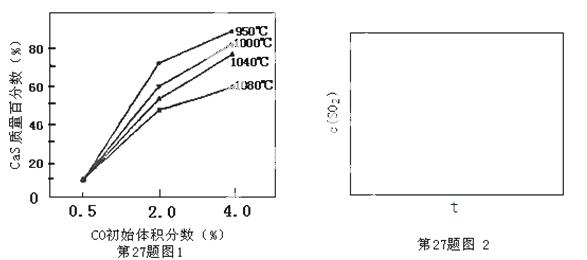
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+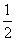 O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+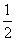 O2(g)===H2O(l) ΔH5
O2(g)===H2O(l) ΔH5
2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)===Ca(OH2)(s) ΔH8
A.① B.④
C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
A.A、B简单离子半径大小关系为B3+>A2+
B.D、E形成的简单离子的还原性:E->D-
C.气态氢化物的稳定性:HD<H2C
D.最高价氧化物对应的水化物的酸性:H2CO4>HEO4
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。
回答下列问题:
(1)五种元素中,原子半径最大的是_______,非金属性最强的是_______
(填元素符号)。
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是________(用化学式表示)。
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为________,其中存在的化学键类型为________。
(4)D最高价氧化物的水化物的化学式为________。
(5)单质D在充足的单质E中燃烧,反应的化学方程式为___________
_____________________________;D在不充足的E中燃烧,生成的主要产物的化学式为________________。
(6)单质E与水反应的离子方程式为______________________________
______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知 Ksp(CaSO4)=9×10-6。下列说法正确的是( )
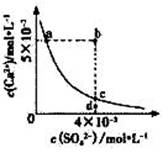
A.a点对应的KSP小于c点对应的KSP B.a点变为b点将有沉淀生成
C.加入蒸馏水可以使c点变为d点 D.含有大量SO42-的溶液中肯定不存在Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期、第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为_______________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为___________________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为____________________,阴极上观察到的现象是____________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为______________________________,这样做的主要缺点是____________________。
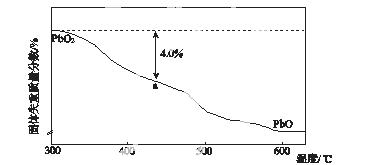
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(即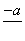 ×100%)的残留固体。若a点固体组成
×100%)的残留固体。若a点固体组成 表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值________________________________________。
表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com