
| 序号 | 实验目的 | 实验设计 |
| A | 证明CH2═CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| B | 鉴别碳酸钠溶液与碳酸氢钠溶液 | 分别加入少量的氢氧化钠溶液,观察现象 |
| C | 实验室制取少量O2气体 | 将蒸馏水滴入过氧化钠固体中,用排水法收集产生的气体 |
| D | 除去硫酸铜溶液中少量的硫酸铁 | 加入过量铜粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳碳双键和醛基都能被酸性高锰酸钾溶液氧化;
B.碳酸氢钠和NaOH反应生成无色的碳酸钠溶液,现象不明显;
C.过氧化钠和水反应生成NaOH和氧气;
D.铜和铁离子反应生成铜离子和亚铁离子.
解答 解:A.醛基和碳碳双键都能被酸性高锰酸钾溶液氧化,所以不能用酸性高锰酸钾溶液检验碳碳双键,故A错误;
B.碳酸氢钠和NaOH反应生成无色的碳酸钠溶液,现象不明显,应该用氯化钡溶液检验,故B错误;
C.过氧化钠和水反应生成NaOH和氧气,可以用过氧化钠和水制取少量氧气,故C正确;
D.铜和铁离子反应生成铜离子和亚铁离子,从而产生新的杂质,故D错误;
故选C.
点评 本题考查化学实验方案评价,涉及官能团的检验、物质的鉴别、气体的制备、除杂等知识点,为高考高频点,明确物质的性质及反应原理是解本题关键,易错选项是D,除杂时要除去杂质且不能引进新的杂质.


科目:高中化学 来源: 题型:多选题
| 酸 | 醋酸 | 次氯酸 | 亚硝酸 |
| 电离常数(Ka) | 1.7×10-5 | 3.0×10-8 | 7.1×10-4 |
| A. | PH相同的氯水和亚硝酸溶液,水电离出的c(H+)相同 | |
| B. | 往氯水滴加NaOH溶液呈中性:c(Na+)=2(ClO-)+c(HClO) | |
| C. | 浓度相等的CH3COONa和NaNO2两份溶液中;c(CH3COO)->c(NO${\;}_{2}^{-}$) | |
| D. | 向pH=a的醋酸溶液中加一定量水,所得溶液的pH>a、pH<a、pH=a均有可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | A、B均为气体,平衡逆向移动 | B. | A为气体,平衡正向移动 | ||
| C. | B为气体,平衡不移动 | D. | A、B都不是气体,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
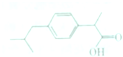 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )| A. | 布洛芬的分子式为C12H18O3 | |
| B. | 布洛芬与苯甲酸(C6H5COOH)互为同系物 | |
| C. | 布洛芬能发生加成、取代等反应 | |
| D. | 丁苯丙酸共有12种可能的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 尿素是蛋白质代谢的产物,也是重要的化学肥料,工业合成尿素反应如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)
尿素是蛋白质代谢的产物,也是重要的化学肥料,工业合成尿素反应如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖与蔗糖 | |
| B. | O2和O3 | |
| C. | $\left.\begin{array}{l}{12}\\{6}\end{array}\right.$C与$\left.\begin{array}{l}{13}\\{6}\end{array}\right.$C | |
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.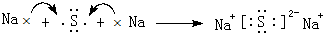 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com