
【题目】在酸性溶液中,可大量共存的离子是( )
A.K+ Na+ OH﹣ SO42﹣
B.Mg2+ SO42﹣ NH4+ Cl﹣
C.K+ Na+ HCO3﹣ Cl﹣
D.K+ Na+ NO3﹣ CO32﹣
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 某有机物的分子式为C4H8,能使溴的CCl4溶液褪色,则它在一定条件下与水反应时最多可生成的有机物(不考虑立体异构)有4种
B. 香叶醇(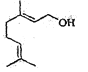 )能发生加成反应不能发生取代反应
)能发生加成反应不能发生取代反应
C. 青蒿素(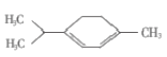 )的一氯代物有5种(不含立体异构)
)的一氯代物有5种(不含立体异构)
D. 苯佐卡因(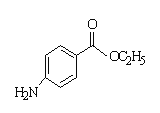 )是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
)是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质,按单质、化合物、混合物的顺序排列的是( )
A.干冰、铁、胆矾
B.液态氧、氧化钙、石灰水
C.氮气、氯化氢、烧碱
D.水、碘酒、熟石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用系统命名法命名有机物 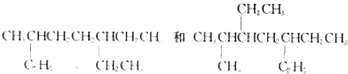 主链碳原子数均为7个
主链碳原子数均为7个
B.某烃的分子式为C10H14 , 它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有4种
C.碳原子数小于或等于8的单烯烃中,与HBr加成产物只有一种结构,符合条件的单烯烃有6种
D.经测定C3H7OH和C6H12组成的混合物中氧的质量分数为8%,则此混合物中碳的质量分数是78%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容。某兴趣小组做如下探究实验:
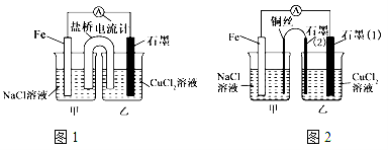
(1)如上图1为某实验小组依据氧化还原反应设计的原电池装置,若盐桥中装有饱和的KNO3溶液和琼胶制成的胶冻,则NO3-移向_____________装置(填写“甲或乙”)。其他条件不变,若将CuCl2溶液换为NH4Cl溶液,发现生成无色无味的单质气体,则石墨上电极反应式______________________。
(2)如上图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则甲装置是____________(填“原电池或电解池”),乙装置中石墨(2)为 极,乙装置中与铁线相连的石墨(1)电极上发生的反应式为 。
(3)在图2乙装置中改为加入CuSO4溶液,一段时间后,若某一电极质量增重 1.28 g,则另一电极生成______________mL(标况下)气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是( )
①H2O ②NH3 ③Cl- ④CN- ⑤CO
A. ①② B. ①②③ C. ①②④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:

b.①N2(g)+O2(g)===2NO(g) ΔH1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-565 kJ·mol-1
(1)ΔH1=________。
(2)在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式:_________。
Ⅱ. SO2、CO、NOx是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径。请回答下列问题:
(1)已知25℃、101 kPa时:
①2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1
2SO3(g) ΔH1=-197 kJ·mol-1
②H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1
③2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是______________________。
(2)若反应2H2(g)+O2(g)===2H2O(g)
ΔH=-241.8 kJ·mol-1,根据下表数据求x=_______kJ·mol-1。
化学键 | H—H | O=O | O—H |
断开1 mol化学 键所需的能量/kJ | 436 | x | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ:一组同学按下图装置(固定装置已略去)进行实验。

(1) A中反应的化学方程式为__________________。
(2) 实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 __________。
(3) 为说明浓硫酸中的水是否影响B装置现象的判断,还需进行一次实验。实验方案为___________。
实验Ⅱ:另一组同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
i. 将光亮铜丝插入浓硫酸,加热;
ii. 待产生黑色沉淀和气体时,抽出铜丝,停止加热;
iii. 冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
查阅文献:检验微量Cu2+的方法是向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+。
(4) 该同学假设黑色沉淀是CuO。检验过程如下:
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,未见红褐色沉淀。由该检验过程所得结论:________________。
(5) 再次假设,黑色沉淀是铜的硫化物。实验如下:
实验装置 | 现象 |
| 1. A试管中黑色沉淀逐渐溶解 2. A试管内上方出现红棕色气体 3. B试管中出现白色沉淀 |
①现象2说明黑色沉淀具有____性。
②能确认黑色沉淀中含有S元素的现象是_______,相应的离子方程式是_____________。
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.氧化还原反应的特征是有元素化合价升降
B.氧化还原反应的本质是有电子转移
C.反应物所含元素的化合价升高,则发生了还原反应
D.氧化反应和还原反应一定同时发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com