



科目:高中化学 来源: 题型:
| A、Ca(OH)2=Ca2++2(OH-) |
| B、FeCl3=Fe2++3Cl- |
| C、Al2(SO4)3=2Al3++3SO42- |
| D、H2SO4=H2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 掌握物质之间的转化,是学习元素化合物知识的基础.
掌握物质之间的转化,是学习元素化合物知识的基础.查看答案和解析>>
科目:高中化学 来源: 题型:
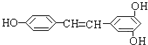 )广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
)广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )| A、1mol,1mol |
| B、3.5mol,7mol |
| C、5mol,7mol |
| D、6mol,7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 |
| B、常温下,1mol/L的CH3COOH溶液与1mol/L的NaOH溶液等体积混合,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 |
| D、常温下,某溶液中有水电离出的c(H+)=10-51mol?L-1,则此溶液可能是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:

 ”结构的物质可发生下列反应:
”结构的物质可发生下列反应:

 )互为同分异构体
)互为同分异构体 ,它在一定条件下也能发生类似Ⅳ的环化反应,写出该化合物发生环化反应的化学方程式
,它在一定条件下也能发生类似Ⅳ的环化反应,写出该化合物发生环化反应的化学方程式 的合成路线流程图:
的合成路线流程图:
| HBr |
| N2OH溶液 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com