
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KI淀粉溶液中通入Cl2,溶液变蓝原因是淀粉能与Cl2发生显色反应 |
| B.浓硝酸在光照条件下变黄是由于浓硝酸不稳定,生成有色物质能溶于浓硝酸 |
| C.某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成说明该溶液中含有SO42- |
| D.常温下,浓硫酸可储存在铁质或铝制器皿中说明常温下铁和铝与浓硫酸不反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
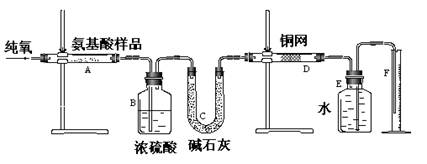
| A.生成二氧化碳气体的质量 | B.生成水的质量 |
| C.通入氧气的体积 | D.氨基酸的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验内容 | 实验的异常情况 | 原因分析 |
| A | 制备Fe(OH)2 | 观察不到白色沉淀 | 可能原料中的Fe2+被氧化或未隔绝空气 |
| B | 蒸发结晶 | 蒸发皿破裂 | 酒精灯灯芯碰到热的蒸发皿底部或蒸发到剩少量液体时继续加热 |
| C | 分离水和CCl4 | 打开分液漏斗活塞后,下层液体难以流出 | 没有装漏斗上塞子拔掉或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| D | 点燃法除去CO2中的CO杂质 | 无法点燃 | CO的着火点较高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 变红,又集得能使带火星的木条复燃的气体0.28L(标况下)。
变红,又集得能使带火星的木条复燃的气体0.28L(标况下)。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
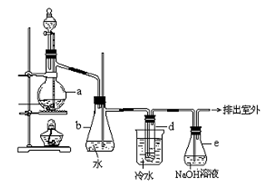
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
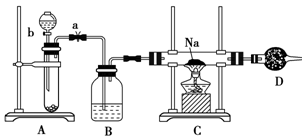
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com