
����Ŀ����������[��Co(OH)2��Fe2O3��Al2O3��MnO��)��������ȡ����������CoCl2��6H2O������������ͼ��ʾ��
������������������������ʽ����ʱ��Һ��pH���±�������������Ũ��Ϊ��0.01mol/L)
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��CoCl2��6H2O�۵�Ϊ86�棬������110��120��ʱ��ʧȥ�ᾧˮ������ˮ�Ȼ��ܡ�
�ش��������⣺
��1������Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��A13+�ȣ�����������Co(OH)3������Ӧ�����ӷ���ʽΪ________��
��2�������м���������NaClO3��������___________��������NaClO3���������ܲ����ж����壬д�����ɸ��ж���������ӷ���ʽ___________________��
��3������Na2CO3������Һ��pH=a,a�ķ�Χ�����___________����������Ҫ�ɷ���______��
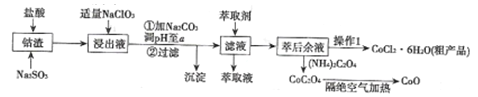
��4����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��ͼ��ʾ��������Һ���м�����ȡ����Ŀ����________����ʹ�õ����pH��Χ��________��
A. 2.0��2.5 B. 3.0��3.5 C. 4.0��4.5 D. 5.0��5.5
��5��������1���а���3������ʵ�����������������______��______���ˡ�
��6��������������CoC2O4����CoO��̼���������Ӧ�Ļ�ѧ����ʽΪ_______________��
���𰸡� 2Co(OH)3+SO32-+4H+=2Co2++SO42-+5H2O ��Fe2+����ΪFe3+ ClO3-+5Cl-+6H+=3Cl2��+3H2O 5.2��7.6 Fe(OH)3��Al(OH)3 ��Mn2+��ȥ B ����Ũ�� ��ȴ�ᾧ CoC2O4![]() CoO+CO+CO2��
CoO+CO+CO2��
��������(1)����Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��A13+�ȣ�˵������������Co(OH)3��������������SO32-����������ԭ��Ӧ����������ӷ���ʽΪ2Co(OH)3+SO32-+4H+=2Co2++SO42-+5H2O��
(2)����������NaClO3�ɽ�Fe2+����ΪFe3+��������ͨ��������ҺpH��ȥ��������Fe3+��������NaClO3�����������������£���������Һ���Cl-�������ж�����Cl2��������Ӧ�����ӷ���ʽΪClO3-+5Cl-+6H+=3Cl2��+3H2O��
(3)����Na2CO3������Һ��pH=a��Ŀ����ʹFe3+��A13+������ȫ����Co2+����������ϲ���������������������ʽ����ʱ��Һ��pH��Χ��֪��a�ķ�Χ�����5.2��7.6�����۳�������Ҫ�ɷ���Fe(OH)3��Al(OH)3��
(4)������ͼ��֪����ʱ��Һ�д���Mn2+��Co2+�������ӣ�������Һ���м�����ȡ����Ŀ���ǽ�Mn2+��ȥ������ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��֪��������ҺPH��3.0��3.5֮�䣬��ʹMn2+��ȫ����������ֹCo2+ת��ΪCo(OH)2�������ʴ�ΪB��
(5)���ô���Һ����ȡ����ķ�����ȡ�Ȼ��ܹ��壬�����1����Ϊ������Ũ������ȴ�ᾧ���ˣ�
(6)������������CoC2O4����CoO��̼��������������ԭ���غ���ƽ��д��Ӧ�Ļ�ѧ����ʽΪCoC2O4![]() CoO+CO+CO2����
CoO+CO+CO2����


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в����뱽�ӷ�����Ӧ����(����)
A.Na2CO3B.NaHCO3C.NaOHD.FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�˶���������ȼ��Ϊ65%�Ķ���(C4H10)��35%�ı��顣����˵������ȷ����(����)
A. ���ȼ����Ҫ�ǽ���ѧ��ת��Ϊ���ܺ��� B. ������ķе�ȱ����
C. ����ͱ��鶼������ˮ D. ����ͱ����ȼ�ղ���Ի�����Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaNO2��һ��ʳƷ���Ӽ��������°�������KMnO4��Һ��NaNO2�ķ�Ӧ����ʽ�ǣ�MnO4��+NO2��+K��Mn2++NO3��+H2O��������������ȷ���ǣ� ��
A.�÷�Ӧ��NO2������ԭ
B.��Ӧ��������Һ��pH��С
C.����1 mol NaNO3������0.4 mol KMnO4
D.K�������OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ��XΪ��Դ��YΪ������ʳ��ˮ�ͷ�̪��Һ����ֽ����ֽ�������һ��KMnO4��Һ��ͨ���Y������Ϻ�ɫ����d����ɢ�������ж���ȷ����( )

A. ��ֽ��c�㸽������ɫ
B. Cu�缫������С��Pt�缫��������
C. Z����Һ��pH�ȼ�С��������
D. ��Һ�е�SO42-��Cu�缫�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
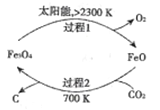
����Ŀ��������̼�Ļ��������ǻ��������о��ȵ㡣
��l����̫���ܵ�����������CO2Ϊԭ����ȡ̿�ڵ�������ͼ��ʾ���ܷ�Ӧ�Ļ�ѧ����ʽΪ_________��
��2����ҵ�Ͽ���CO2��H2��Ӧ�Ƶü״�����2��105Pa��300������������CO2��H2��Ӧ���ɼ״���Һ̬ˮ��������2molCO2ʱ�ų�98kJ���������÷�Ӧ���Ȼ�ѧ����ʽΪ___________��
��3��������CO2��CH4�������ƺϳ�������Ҫ�ɷ�ΪCO��H2��, ��ԭ��Ϊ��CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)�����ܱ�������ͨ�����ʵ�����Ϊ1mol��CH4��CO2����һ�������·�����Ӧ��CH4��ƽ��ת�������¶ȼ�ѹǿ����λPa���Ĺ�ϵ��ͼ��ʾ��
2CO(g)+2H2(g)�����ܱ�������ͨ�����ʵ�����Ϊ1mol��CH4��CO2����һ�������·�����Ӧ��CH4��ƽ��ת�������¶ȼ�ѹǿ����λPa���Ĺ�ϵ��ͼ��ʾ��
��ѹǿ��P1_____P2������>������=������<������ͬ) , y�㣺V��_______V����
����֪�����ѹ��P����=������ѹ��P���������������������������ѹ����ƽ��Ũ�ȿ��Եõ�ƽ�ⳣ��KP����X���Ӧ�¶��·�Ӧ��ƽ�ⳣ��KP=________��

��4��Na2CO3��ҺҲͨ����������CO2���������·�Ӧ��CO32-+CO2+H2O![]() 2HCO3-����0.12mol/LNa2CO3��Һ������CO2һ��ʱ�����Һ��pH=7����Һ��c(HCO3-)/c(CO32-)=10������Һ�е�c(CO32-) =__________��
2HCO3-����0.12mol/LNa2CO3��Һ������CO2һ��ʱ�����Һ��pH=7����Һ��c(HCO3-)/c(CO32-)=10������Һ�е�c(CO32-) =__________��
��5���״�ȼ�ϵ�أ����DMFC������Ϊ������Դ�����Ʒ�����ܹ�ע��DMFC�Ĺ���ԭ����ͼ��ʾ��
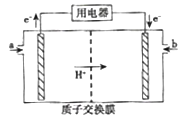
�ټ���a���ʵĵ缫�ǵ�ص�______��������������������������缫��ӦʽΪ_______��
�ڳ������Ը�װ������Դ�������Ե缫���NaCl��CuSO4�Ļ����Һ������·��ͨ��0.4 mol ���ӵĵ���ʱ�����缫���õ�0.14mol�����塣��������Һ���Ϊ40L���������Һ��pH=_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2NO2������ɫ��![]() N2O4����ɫ����H��0����һ������NO2����ע�����в��ܷ⣬�ı����λ�õĹ����У�����������ʱ��ı仯��ͼ��ʾ��������ɫԽ�����ԽС��������˵������ȷ���ǣ� ��
N2O4����ɫ����H��0����һ������NO2����ע�����в��ܷ⣬�ı����λ�õĹ����У�����������ʱ��ı仯��ͼ��ʾ��������ɫԽ�����ԽС��������˵������ȷ���ǣ� ��

A. b��ﵽƽ��״̬
B. b����a����ȣ�c��NO2����c��N2O4������С
C. d�㣺v��������v������
D. ����c�㽫�¶Ƚ��ͣ������ʽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ȷ���ǣ� ��
A.H��D��T������ͬ��������������Ԫ�ص����ֺ���
B.OH-��H3O+���Ԫ����ͬ��������������ͬ
C.13C��15N����ͬ��������
D.15N����������������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com