

| A. | 离子半径:d3+<f- | |
| B. | 原子失电子能力:c>d | |
| C. | 最简单气态氢化物的热稳定性:a<e | |
| D. | b、c两元素可组成既含离子键又含共价键的化合物 |
分析 由部分短周期主族元素原子半径与原子序数的关系图,可知分别为二、三周期元素,结合原子序数可知,a为C元素,b为O,c为Na,d为Al,e为Si,f为Cl.
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大
B.金属性越强,失去电子能力越强;
C.非金属性越强,氢化物越稳定;
D.b和c形成的化合物有氧化钠、过氧化钠.
解答 解:由部分短周期主族元素原子半径与原子序数的关系图,可知分别为二、三周期元素,结合原子序数可知,a为C元素,b为O,c为Na,d为Al,e为Si,f为Cl.
A.Al3+离子比Cl-离子少一个电子层,故离子半径Al3+<Cl-,故A正确;
B.金属性c(Na)>a(Al),金属性越强,失去电子能力越强,故B正确;
C.非金属性a(C)>e(Si),非金属性越强,氢化物越稳定,故气态氢化物的稳定性:a>e,故C错误;
D.b和c形成的化合物有氧化钠、过氧化钠,过氧化钠中含有离子键、共价键,故D正确,
故选C.
点评 本题考查元素周期律与元素周期律,难度不大,需要学生熟练掌握元素周期表,注意掌握微粒半径比较,有利于基础知识的巩固.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:解答题
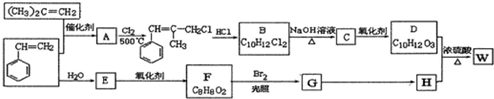
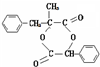 .
.  ;由D生成高分子化合物的方程式为
;由D生成高分子化合物的方程式为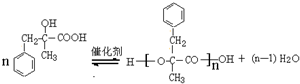 .
.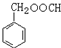 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
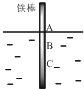 将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )
将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是( )| A. | 铁棒AB段发生反应为O2+4e-+2H2O=4OH- | |
| B. | 腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段 | |
| C. | 向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 | |
| D. | 产生这种现象的本质原因是铁棒所处的化学环境不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g聚丙烯中含C-H键总数目为2NA | |
| B. | 1molFe与足量的稀硝酸反应转移电子总数目为2NA | |
| C. | 标准状况下,44.8L乙醛中含乙醛分子总数目为2NA | |
| D. | 常温常压下,200g质量分数为17%H2O2溶液中含氧原子总数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
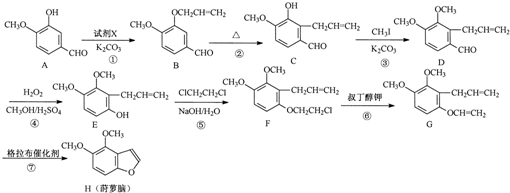
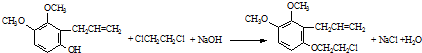 .
.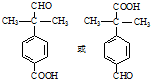 .
.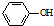 为原料制备
为原料制备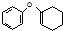 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
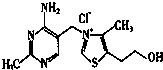
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
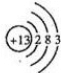
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | HCl、HBr、HI的稳定性依次增强 | |
| C. | 钠、镁、铝的还原性依次减弱 | |
| D. | P、S、Cl最高正价依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、P、As的电负性随原子序数的增大而增大 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| C. | 2p和3p轨道形状均为纺锤形,能量也相等 | |
| D. | 氮原子的最外层电子的轨道表示式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com