
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成xmol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成xmol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为xmol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() xmol
xmol
A.①B.①②C.①④D.②③
【答案】A
【解析】
反应H2(g)+Br2(g) ![]() 2HBr(g)中,反应方程式两边气体的体积不变,压强不影响化学平衡,只要加入的各物质按照化学计量数完全转化成反应物氢气和溴,满足n(A):n(B)=1molH2:2mol=1:2,就属于等效平衡,反应体系中各组分的含量一定相等,据此进行分析。
2HBr(g)中,反应方程式两边气体的体积不变,压强不影响化学平衡,只要加入的各物质按照化学计量数完全转化成反应物氢气和溴,满足n(A):n(B)=1molH2:2mol=1:2,就属于等效平衡,反应体系中各组分的含量一定相等,据此进行分析。
反应H2(g)+Br2(g) ![]() 2HBr(g)中,反应方程式两边气体的体积不变,压强不影响化学平衡,只要加入的各物质按照化学计量数完全转化成反应物氢气和溴,满足n(A):n(B)=1molH2:2mol=1:2,就属于等效平衡,反应体系中各组分的含量一定相等。①a,b,c满足的关系为:4a+c=2b,就满足Br2和H2的物质的量比为2∶1,选项①正确;②达到平衡时HBr的物质的量为xmol,无法确定Br2和H2的物质的量比,选项②错误;③a、b、c满足的关系为a+b=c很难,且无法确定Br2和H2的物质的量比,选项③错误;④该反应两边气体的体积不变,反应后气体的物质的量还是3mol,溴化氢的含量为
2HBr(g)中,反应方程式两边气体的体积不变,压强不影响化学平衡,只要加入的各物质按照化学计量数完全转化成反应物氢气和溴,满足n(A):n(B)=1molH2:2mol=1:2,就属于等效平衡,反应体系中各组分的含量一定相等。①a,b,c满足的关系为:4a+c=2b,就满足Br2和H2的物质的量比为2∶1,选项①正确;②达到平衡时HBr的物质的量为xmol,无法确定Br2和H2的物质的量比,选项②错误;③a、b、c满足的关系为a+b=c很难,且无法确定Br2和H2的物质的量比,选项③错误;④该反应两边气体的体积不变,反应后气体的物质的量还是3mol,溴化氢的含量为![]() ,达到平衡时两个平衡中溴化氢的含量相等,所以达到平衡时HBr物质的量为
,达到平衡时两个平衡中溴化氢的含量相等,所以达到平衡时HBr物质的量为![]() xmol,选项④错误。故选A。
xmol,选项④错误。故选A。


科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是
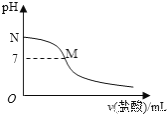
A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意,完成下列问题。
(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液pH=_____。
(2)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=______。该温度__________25℃(填“高于”、“低于”或“等于”)。
(3)常温下,设pH=5的H2SO4的溶液中由水电离出的H+浓度为c1;pH=9的Ba(OH)2溶液中由水电离出的H+浓度为c2,则c1/ c2=__________。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。
若所得混合溶液呈中性,则a∶b=__________。若所得混合溶液pH=12,则a∶b=__________。
(5)向明矾溶液中逐渐加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH______7(填>,<,=),离子反应总方程式为______________________。
(6)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:a.称取一定质量的HA配制成0.1molL-1的溶液100mL;
b.用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:a.用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各 100mL;
b.分别取这两种溶液各10mL,加水稀释为100mL;
c.各取相同体积的两种稀释液装入两个试管中,同时加入纯度相同的锌粒,观察反应现象,即可证明HA是弱电解质。
①在两个方案的第①步中,都要用到的定量仪器是_______。
②甲方案中,说明HA是弱电解质的理由是测得溶液的pH____1(选填“>”、“<”或“=”)。
乙方案中,说明HA是弱电解质的现象是_______(多选扣分)。
A.装HCl溶液的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中生成气体的速率一样快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示:
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 24.60 |
回答下列问题:
(1)如图中甲为_________滴定管,乙为_______ 滴定管(填“酸式”或“碱式”)
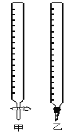
(2)实验中,不需要润洗的仪器是:________________________
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是________
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果____________(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果___________。
(5) 未知浓度的NaOH溶液的物质的量浓度为_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,分别向20.00mL 0.10mol·L-1的氨水、醋酸铵溶液中滴加0.10mol·L-1的氢碘酸,溶液pH与加入氢碘酸体积的变化关系如图所示。下列说法正确的是
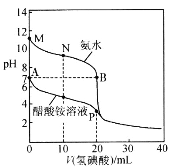
A.A点与B点由水电离产生的氢氧根浓度A点大于B点
B.M点,c(NH3·H2O)>c(OH-)>c(H+)>c(NH4+)
C.N点,c(I-)=c(NH3·H2O)+c(NH4+)
D.P点,c(H+)+c(CH3COOH)=c(OH-)+c(I-)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中d区与ds区元素,又称过渡金属元素,应用广泛。
(1)我国秦陵内发掘了镀铬宝剑,震动了世界,因为这种铬盐氧化处理是近代才掌握的先进工艺。Cr3+基态核外M层电子排布式为_________;基态Zn原子核外K层和L层电子的电子云有______种不同的伸展方向。
(2)锌化铜是一种金属互化物,其化学式有多种形式,如CuZn,Cu5Zn8,CuZn3等。其中所含元素铜的第二电离能________(填“大于”“小于”或“等于”)锌的第二电离能。
(3)[Co(DMSO)6](C1O4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为OS(CH3)2。晶体中C1O4-的空间构型是_____________,晶体中所含元素Co、C1、O的电负性由大到小的顺序为___________________;DMSO中硫原子的杂化轨道类型为_____________,1个OS(CH3)2分子中含有σ键数目为_____________。
(4)某晶体晶胞结构如图所示,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ),则d点Cu原子的坐标参数为_____________,已知该晶体的晶胞参数为a cm,密度为ρgcm-3,则NA=_____mol-1。(列出含a,ρ的计算式)
),则d点Cu原子的坐标参数为_____________,已知该晶体的晶胞参数为a cm,密度为ρgcm-3,则NA=_____mol-1。(列出含a,ρ的计算式)
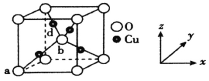
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池构造如图所示,下列叙述正确的是( )

A. 在外电路中,电子由银电极流向铜电极
B. 取出盐桥后,电流表的指针仍发生偏转
C. 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D. 原电池的总反应式为Cu+2AgNO3===2Ag+Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如下:
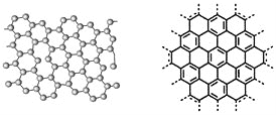
(1)下列有关石墨烯说法正确的是________。
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12 g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为________。
②乙醇沸点比氯乙烷高,主要原因是_______________________。
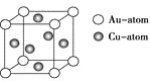
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:________。
④含碳原子且属于非极性分子的是________;
a.甲烷 b.乙炔 c.苯 d.乙醇
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:________。
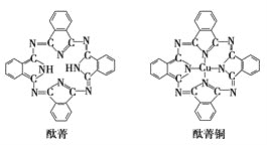
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。请填写下列空白:
(1)移取10.00mL密度为ρg/mL的过氧化氢溶液至250mL容量瓶中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下。2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(3)滴定时,将高锰酸钾标准溶液注入___(填“酸式”或“碱式”)滴定管中,滴定到终点。
(4)重复滴定三次,平均耗用cmol/LKMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的质量分数为___。
(5)若滴定前仰视滴定管读数,滴定后平视,则测定结果___(填“偏高”、“偏低”或“不影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com