
下列实验设计和结论的说法不正确的是
A.将碘水倒入分液漏斗,加适量四氯化碳,振荡后静置,可将碘萃取到下层液体中
B.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
C.加入盐酸以除去硫酸钠中的少量碳酸钠杂质
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,会得到含氢氧
化铁的FeCl3溶液
C
【解析】
试题分析:A.将碘水倒入分液漏斗,加适量四氯化碳,由于四氯化碳密度比水大,碘容易在四氯化碳溶解,而又与水互不相溶,因此振荡后静置,可将碘萃取到下层液体中,正确;B. 向AlCl3溶液中滴加氨水,产生Al(OH)3白色沉淀;若再加入过量NaHSO4溶液,盐电离产生的H+会溶解Al(OH)3,使沉淀消失,正确;C. 硫酸钠中的少量碳酸钠杂质,若加入盐酸,碳酸钠与盐酸反应,但是会引入新的杂质NaCl,错误;D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,2FeCl2+Cl2=2FeCl3,充分加热,可以除去过量的Cl2,但是会促进FeCl3水解,得到含氢氧化铁的FeCl3溶液,正确;
考点:考查实验设计和结论的正误判断的知识。


科目:高中化学 来源:2014-2015学年江西省赣州市高一上学期第一次月考化学卷(解析版) 题型:填空题
甲、乙、丙三种物质有如下图所示的转化关系。
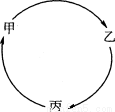
I.若甲、乙、丙依次是氢气、水、硫酸。
(1)写出甲→乙的化学方程式: 。
(2)乙→丙时所需另一种反应物中,一定含有 和氧元素。
Ⅱ.若甲为碳酸钙,丙为氯化钙。
(3)乙可以是 。
Ⅲ.已知难溶性的碱受热会分解生成相应的金属氧化物和水。若甲是铁锈的主要成分,乙的溶液呈黄色。
(4)甲→乙还需要的试剂可以是 。
(5)写出乙→丙的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高二上学期期中化学(理)试卷(解析版) 题型:填空题
(每空2分,共12分)(1)用NA代表阿伏加德罗常数,在C2H2(g)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为___________________________。
(2)已知拆开1 mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436 kJ,391kJ,946 kJ,则N2和H2反应生成NH3的热化学方程式为______________________。
(3)实验室有PH=4的盐酸、硫酸、醋酸三瓶溶液:(以下用“>、=、<”表示)
① 若取相同体积的上述三种酸分别加入蒸馏水稀释至PH=6,需要水的体积依次为V1、 V2、V3则其关系为 。
② 若完全中和体积和物质的量浓度均相同的Ba(OH)2,需上述三种酸的体积依次为V1、V2、V3,则其关系是 。
③ 若取同体积的上述三种酸溶液分别加入足量的锌粉,反应开始放出H2 的速率依次为v1,v2,v3,则其关系是 ;相同状况下产生气体体关系是__________ (用V1、V2、V3表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高二上学期期中化学(理)试卷(解析版) 题型:选择题
有一支50mL酸式滴定管其中盛有溶液,液面恰好在10mL刻度处,现把管内溶液全部流下排出,用量筒承接,该溶液的体积应为
A.10mL B.40mL C.大于40mL D.小于40ml
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三上学期第二次月考化学试卷(解析版) 题型:填空题
(本小题共4分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)离子方程式是重要的化学用语。下列是有关离子反应的一些错误观点,请在下列表格中用相应的一个“离子方程式”否定这些观点。(不能相同)
①强酸与强碱发生中和反应均可表示为:H++OH-=H2O |
|
②强酸与碱混合一定发生中和反应 |
|
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
B.SO2通入Fe2(SO4)3溶液中,无明显现象
C.SO2通入已酸化的Ba(NO3)2溶液中,出现白色沉淀
D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高一上学期第一次月考化学试卷(解析版) 题型:实验题
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.2mol/L的盐酸溶液,填空并请回答下列问题:
(1) 配制250mL0.2mol/L的盐酸溶液
计算应称量盐酸体积/mL | 应选用容量瓶的规格/mL | 除量筒、容量瓶、烧杯外还需的其它仪器 |
|
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) _ __ __;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 ____ ,
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
若没有进行A操作 ;
若加蒸馏水时不慎超过了刻度 ;
若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面__________________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列仪器常用于物质分离的是

① ② ③ ④ ⑤ ⑥
A.②⑤⑥ B.②③⑤ C.②④⑤ D.①③⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高二上学期期中化学试卷(必修)(解析版) 题型:填空题
(6分)在下图所示的物质转化关系中,A是用于制造汽车发动机的耐高温陶瓷材料,A由两种元素组成,且两种元素化合价的绝对值相等。常温下,C、F、K是无色无味的气体单质,D、H是固体单质。E是常见的两性氧化物。B、G是汽车尾气中的主要污染气体,所含元素均为第二周期元素。反应②常用于汽车尾气的处理。
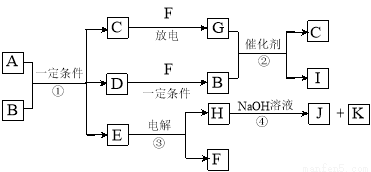
(1)C的电子式 。
(2)A的化学式 。
(3)反应③的化学方程式 。
(4)反应④的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com