
| A. | 75%的酒精用于消毒 | B. | Al(OH)3可用于治疗胃酸过多 | ||
| C. | 明矾用于水的杀菌消毒 | D. | 从海底提取可燃冰 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有X、Y、Z三种物质,它们之间存在如图转化关系:
有X、Y、Z三种物质,它们之间存在如图转化关系: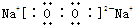 ;Y、Z两种物质相比,相同的化学键类型为离子键,当由X制取Z的上述两种途径生成Z的量相等时,转移电子数目比为1:2.
;Y、Z两种物质相比,相同的化学键类型为离子键,当由X制取Z的上述两种途径生成Z的量相等时,转移电子数目比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃--通入澄清石灰水--加溴水 | |
| B. | 点燃--罩上干燥烧杯--通入澄清石灰水 | |
| C. | 点燃--通入澄清石灰水 | |
| D. | 点燃--通入酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3比NaHCO3稳定 | |
| B. | 溶解性:NaHCO3比Na2CO3易溶于水 | |
| C. | 相同质量的Na2CO3和NaHCO3分别与足量HCl反应,Na2CO3放出CO2少 | |
| D. | 相同物质的量浓度的Na2CO3和NaHCO3溶液分别与同浓度的盐酸反应,产生气体的速率Na2CO3小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.48 mol | B. | 0.43 mol | C. | 0.42 mol | D. | 0.32 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com