
| A. | K[Ag(CN)2]、[Cu(NH3)4]SO4 | B. | [Ni(NH3)4]Cl2、[Ag(NH3)2]Cl | ||
| C. | [Ag(NH3)2]Cl、[Cu(NH3)2]Cl2 | D. | [Ni(NH3)4]Cl2、[Cu(NH3)4]SO4 |
分析 配合物中,配离子:含有配位键的离子,可以是阳离子或阴离子;
内界、外界:内界指配位单元,外界与内界相对;
配位体:提供孤电子对的分子或离子;
配位原子:配体中,提供电子对的原子;
中心原子:一般指接受电子对的原子;
配位数:中心原子周围的配位原子个数,据此分析解答.
解答 解:A.K[Ag(CN)2]中中心离子是Ag+,中心离子电荷数是1,CN是配体,配位数是2;[Cu(NH3)4]SO4中中心离子是Cu2+,中心离子电荷数是2,NH3是配体,配位数是4,二者中心离子的电荷数和配位数均不相同,故A错误;
B.[Ni(NH3)4]Cl2中中心离子是Ni2+,中心离子电荷数是2,NH3是配体,配位数是4,[Ag(NH3)2]Cl中中心离子是Ag+,中心离子电荷数是1,NH3是配体,配位数是2,
二者中心离子的电荷数和配位数均不相同,故B错误;
C.[Ag(NH3)2]Cl中中心离子是Ag+,中心离子电荷数是1,NH3是配体,配位数是2;[Cu(NH3)2]Cl2中中心离子是Cu2+,中心离子电荷数是2,NH3是配体,配位数是2,二者中心离子电荷数不同,故C错误;
D.[Ni(NH3)4]Cl2中中心离子是Ni2+,中心离子电荷数是2,NH3是配体,配位数是4;[Cu(NH3)4]SO4中中心离子是Cu2+,中心离子电荷数是2,NH3是配体,配位数是4,二者中心离子电荷数及配位数相同,故D正确;
故选D.
点评 本题考查配合物中中心离子电荷数、配位数的判断,侧重概念的考查,明确配合物中內界、外界、中心原子、配原子、配位数等概念即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 丙炔 | B. | 乙烯 | C. | 乙炔 | D. | 丁烯? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O的沸点比较高,是由于水分子间存在氢键的原因 | |
| B. | 除稀有气体外的非金属元素都能生成不同价态的含氧酸 | |
| C. | 若ⅡA族某元素的原子序数为m,则同周期ⅢA族元素的原子序数可能为m+11 | |
| D. | 由于分子间作用力比化学键弱得多,所以干冰升华容易,而CO2气体分解却不易 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:溴苯>H2O>苯 | |
| C. | 含碳量:甲烷>乙烯>乙炔>苯 | |
| D. | 等物质的量燃烧耗O2量:己烷<环己烷<苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若M的最高正化合价为+4,则五种元素都是非金属元素 | |
| B. | HnJOm为强酸,则G是位于ⅤA族以后的活泼非金属元素 | |
| C. | 若T的最低化合价为-3,则J的最高正化合价为+7 | |
| D. | 若R、M的最高价氧化物的水化物均为碱,则R(OH)n的碱性一定比M(OH)n+1的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它位于周期表的第四周期、第IA族 | |
| B. | 碳酸铷易加热分解为氧化铷和二氧化碳 | |
| C. | 铷的盐类大多易溶于水 | |
| D. | 氯化铷是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
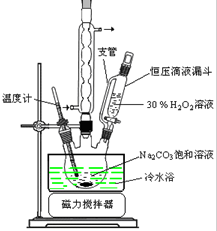 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com