
工业上常以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)已知将MnO2、ZnS浸在硫酸溶液中有少量黄色物质析出,写出并配平该化学反应方程式: 。
(2)在酸浸的过程中还会发生以下反应:
a. 3MnO2 +2FeS +6H2SO4=3MnSO4 +Fe2(SO4)3+2S+ 6H2O
b. MnO2+CuS+4H2SO4=MnSO4+CuSO4+S+2H2O
c. Al2O3+3H2SO4=Al2(SO4)3+3H2O
将酸浸所得的酸性溶液按以下的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO2和Zn。

①操作①中加Zn粉后发生反应的离子方程式为:Zn+2H+=Zn2++H2↑、
Zn+Cu2+=Zn2++Cu、 。
②操作②中加入适量X的作用是: 。
③操作③中所加碳酸盐的化学式是: 。
(3)为了从上述流程中产生的Fe(OH)3 、Al(OH)3沉淀混合物中回收Al(OH)3,某化学兴趣小组设计了如下两种方案图。
方案Ⅰ

方案Ⅱ

①方案Ⅰ中,AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为:
。若总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量分别为: mol、 mol。
②从消耗酸碱的用量角度考虑,方案 (填“Ⅰ”或“Ⅱ”)所消耗的酸碱少些。
(1)MnO2 +ZnS +2H2SO4=MnSO4+ZnSO4+S↓+2H2O(2分)
(2)①Zn+2Fe3+=Zn2++2Fe2+(2分) ②将Fe2+氧化成Fe3+ (2分) ③MnCO3或ZnCO3 或MnCO3和ZnCO3(2分)
(3)① Al3++3AlO2-+6H2O=4Al(OH)3 ↓(2分); 3n/4(1分)、3n/4 (1分)②Ⅰ(1分)
【解析】
试题分析:(1)由信息将MnO2、ZnS浸在硫酸溶液中有少量黄色物质S析出,故MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O。
(2)从电解溶液(Ⅳ)即得MnO2和Zn可知反应①中的Mn2+置换出来,故①中还有Zn+2Fe3+=Zn2++2Fe2+;②后面得到Fe(OH)3沉淀,说明X是将Fe2+氧化成Fe3+的氧化剂;为了不引进新杂质,调节溶液pH的最好用MnCO3或ZnCO3。
(3)方案I的最终反应是AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl,可以得出①Al3++3AlO2-+6H2O=4Al(OH)3↓;因4Al(OH)3↓~3NaCl~3NaOH~3HCl,故总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量都 3n/4mol。
考点:流程中的化学反应原理的应用。


科目:高中化学 来源:2013-2014湖南省益阳市高二上学期期末考试化学试卷(解析版) 题型:简答题
5.8g有机物完全燃烧,只生成CO2和H2O气其体积比为1:1(同压同温),若把它们通过碱石灰,碱石灰增加18.6g,同量的有机物与0.1 mol乙酸完全发生酯化反应。又知该有机物对空气的相对密度为2。
求:(1)有机物的相对分子质量;
(2)有机物的分子式;
(3)此有机物的名称。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(15分)【化学—选修3:物质结构与性质】
a、b、c、d、f五种前四周期元素,原子序数依次增大;a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b),且其中基态b原子的2p轨道处于半充满状态; d为周期表前四周期中电负性最小的元素;f的原子序数为29。请回答下列问题。(如需表示具体元素请用相应的元素符号)
(1)写出ac2的电子式__________;基态f原子的外围电子排布式为 。
(2)写出一种与ac2互为等电子体的物质的化学式 。
(3)b的简单氢化物的沸点比同族元素氢化物的沸点 。(填“高”或“低”)

(4)化合物M由c、d两种元素组成,其晶胞结构如甲,则M的化学式为 。
(5)化合物N的部分结构如乙,N由a、b两元素组成,则硬度超过金刚石。试回答:①N的晶体类型为________________________,其硬度超过金刚石的原因是___________________。
②N晶体中a、b两元素原子的杂化方式均为___________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第三次模拟考试理综化学试卷(解析版) 题型:实验题
(15分)某校一研究性学习小组对胆矾晶体受热分解进行讨论。
Ⅰ.他们查阅资料得知:将胆矾晶体置于烘箱中加热时,在79~134℃,晶体失重14.4%;134~250℃,又失重14.4%;250~300℃,再失重7.2%。之后加热至620℃,质量维持不变。小组经过计算得出,胆矾在300~620℃的固体残留物为无水硫酸铜,134℃时的固体残留物的化学式为 。
Ⅱ.小组对无水硫酸铜继续升温加热的可能变化进行猜想。他们提出了产物的以下几种猜想:
①.CuO、SO3 ;。
②.CuO、SO2和O2;
③.CuO、SO3和SO2;
④.CuO、SO3、SO2和O2
小组经过激烈讨论,认为猜想③不用实验就可排除,他们的理由是
查阅资料:①SO3为无色晶体,熔点16.6℃,沸点44.8℃。
②SO2,熔点:-72.4℃,沸点:-10℃;SO2通入BaCl2溶液中,无明显现象。
Ⅲ.实验探究:
小组按下图所示安装好实验装置。

(1)安装好装置后,未装药品前必须进行的操作是 。
D装置的作用是 。
(2)按图示装好药品后,用酒精喷灯对着硬质试管加热。一会儿后,B中溶液产生白色浑浊,C中溶液逐渐褪色。
Ⅳ.实验结果分析:
(1)小组同学大多认为无水硫酸铜热分解产物应该为猜想④。但有一个同学提出质疑,他认为B中溶液产生白色浑浊并不一定能确定产物中含有SO3。他的依据涉及的化学方程式是 。于是,小组同学经讨论决定,再增加一个装置E,你认为该装置应加在 (填装置字母)之间。增加装置后,小组重新实验,证明了产物中确实存在SO3。你认为他们根据什么现象得到这一结论? 。
(2)小组在完成无水硫酸铜热分解的化学方程式时遇到了困难。他们发现该化学方程式为不定方程式,存在无数种配平情况,经过慎密地分析,他们认为只要能确定某些物质的计量数之比,即可确定该化学方程式。如已知SO2与SO3的计量数之比,就能确定该化学方程式。若设SO2与SO3的计量数之比为x,请写出配平后的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.煤的干馏、石油的分馏都是物理变化
B.工业上常用澄清石灰水和氯气反应制漂白粉
C.蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,都属于“盐析”
D.二氧化硅可以用于制造光导纤维,光导纤维遇强碱会“断路”
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省岳阳市高三教学质量检测二理综化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.在硫化钠溶液中加入足量稀硝酸: S2-+ 2H+ = H2S↑
B.往氯化铁溶液中通入硫化氢气体: 2Fe3++ S2- = 2Fe2++ S↓
C.用惰性电极电解饱和食盐水:2Cl- +2H2O通电2OH- + H2↑ + Cl2↑
D.乙醛的银镜反应:CH3CHO+2Ag(NH3)2OH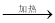 CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:填空题
(8分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,且气体体积为标况体积):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大_____ ______,
原因是 。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体
积的下列溶液,你认为可行的是__________。
A.蒸馏水 B.NaCl溶液 C.NaNO3溶液 D.CuSO4溶液 E.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:选择题
CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公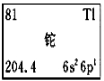 众关注的焦点。铊的相关信息如下图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子。下列有关卡片信息解读不正确的是
众关注的焦点。铊的相关信息如下图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子。下列有关卡片信息解读不正确的是
A.铊的元素符号为Tl B.铊原子的中子数为204
C.铊位于第六周期ⅢA族 D.铊的金属性比铝的金属性强
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:选择题
在5L的密闭容器中进行下述反应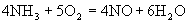 30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
A.V(O2 )=0.01mol·L-1·s-1 B. V(NO )=0.08mol·L-1·s-1
C. V(H2O)=0.01mol·L-1·s-1 D. V(NH3)=0.002mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com