
【题目】下列关于氮及其化合物说法,不正确的是
A.人体中极少量的NO会促进血管扩张,防止血管栓塞
B.光化学烟雾即为含有二氧化氮的有毒烟雾
C.氨水可作化肥
D.工业硝酸常因溶有少量NO2而略显黄色
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。

请回答下列问题:
(1)硫酸亚铁溶液加H2SO4酸化的主要目的是_________,滤渣A的主要成分是________。
(2)下列物质中最适合的氧化剂B是______(填字母);反应的离子方程式___________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲名称分别是:甲______________,乙为常温晾干。
(4)上述流程中,氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,所加试剂为__(写化学式),能否用酸性的KMnO4溶液?_________填“能”或“否”)理由是:_______。(可用语言或方程式说明)
(5)称取14.00 g样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba(NO3)2溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的CH4和NH3相比较,下列结论错误的是
A. 它们的分子个数比为17:16 B. 它们的原子个数比为17:16
C. 它们的氢原子个数比为17:12 D. 它们所含氢元素的质量比为17:12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选用适当的试剂和除杂方法除去下列各物质中的杂质(括号中为杂质),将所选试剂和操作的名称填写在表格中.
序号 | 物质 | 试剂 | 除杂方法 |
① | 甲烷(C2H4) | ||
② | 硝基苯(混合酸) | ||
③ | KNO3(NaCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是
A. 浓硝酸保存在无色玻璃试剂瓶中
B. 少量的钠保存在煤油中
C. 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中
D. 新制的氯水通常保存在棕色玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)将CO2气体持续通入澄清石灰水中,发现澄清石灰水先浑浊,后又变澄清,写出在该过程中所涉及的化学方程式:
(2)Cu与浓硫酸反应的化学反应方程式: 其中在此反应中,硫酸体现了什么性质:
(3)海水提镁中,贝壳的作用是(用化学反应方程式表示):
(4)工业上制备粗硅的化学方程式是:
(5)SiO2是玻璃的成分之一,SiO2与氢氧化钠溶液反应的化学方程式为 , 工艺师常用(填物质名称)来雕刻玻璃.
(6)工业上常采用碳酸盐与石英为原料制取玻璃,请写出工业制取玻璃的化学反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关食物中营养素的说法正确的是( )
A.维生素C能防治坏血病B.摄入过多的淀粉不会发胖
C.油脂的成分是高级脂肪酸D.蛋白质水解的最终产物是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠常用作食品防腐剂。现用下图所示仪器(夹持装置已省略)及药品。探究亚硝酸钠与硫酸的反应及生成气体产物的成分。巳知气体液化的温度:NO2:21℃;NO:-152 ℃
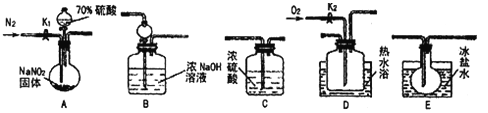
回答下列问题:
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按从左到右连接): A→C→___→____→______。
(2)组装好仪器后,接下来进行的操作是____;实验开始时通入N2的作用是______.
(3)关闭弹赞夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。确认A中产生的气体中含有NO,依据的现象是__________;装置E的作用是__________。
(4)根据上述实验,写出该反应的化学方程式:__________。
如果没有装置C,对验证结论造成的影响是__________。
(5)实验结束后还需通入N2的作用是_______;如果向D中通入过量O2,则装置B中发生反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的NO3﹣对人类健康会产生危害,为了降低饮用水中NO3﹣的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3﹣还原为N2 , 其化学方程式为Al+NaNO3+NaOH﹣NaAlO2+N2↑+H2O (未配平).请回答下列问题:
(1)上述反应中,元素的化合价升高,则该元素的原子(填“得到”或“失去”)电子;而元素的化合价降低,则该元素的原子被(填“氧化”或“还原”).
(2)配平上述反应:Al+NaNO3+NaOH=NaAlO2+N2↑+H2O
(3)用“双线桥法”表示反应中电子转移的方向和数目:
(4)上述反应中若标准状况下产生11.2L气体物质,则转移电子的数目为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com