

 ,故答案为:
,故答案为: ;
;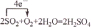 ,故答案为:
,故答案为: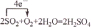 .
.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、①②⑥ | B、③④⑥ |
| C、③⑤ | D、③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应MgCl2(l)=Mg(l)+Cl2(g)的△H<0,△S>0 |
| B、熵是一个与内能有关的物理量 |
| C、1mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D、1mol H2与0.5mol O2反应放出的热就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | NaOH溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | IA | O | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com