
| 温度/°C | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应;
(2)根据△c=v△t计算△c(A),A的起始浓度-△c(A)=6s时c(A);
根据△n=△cV计算△n(A),再根据方程式计算C的物质的量;
设平衡时A的浓度变化量为x,利用三段式表示平衡时各组分的平衡浓度,代入平衡常数列方程计算x的值,再根据转化率定义计算;
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数.
解答 解:(1)可逆反应A(g)+B(g)?C(g)+D(g)的平衡常数表达式K=$\frac{c(C)c(D)}{c(A)c(B)}$,
由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0,
故答案为:$\frac{c(C)c(D)}{c(A)c(B)}$;<;
(2)反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1,则6s内△c(A)=0.003mol•L-1•s-1×6s=0.018mol/L,A的起始浓度为$\frac{0.2mol}{5L}$=0.04mol/L,故6s时时c(A)=0.04mol/L-0.018mol/L=0.022mol/L,
故6s内△n(A)=0.018mol/L×5L=0.09mol,由方程式可知n(C)=△n(A)=0.09mol,
设平衡时A的浓度变化量为x,则:
A(g)+B(g)?C(g)+D(g)
开始(mol/L):0.04 0.16 0 0
变化(mol/L):x x x x
平衡(mol/L):0.04-x 0.16-x x x
故$\frac{{x}^{2}}{(0.04-x)(0.16-x)}$=1,解得x=0.032
所以平衡时A的转化率为$\frac{0.032mol/L}{0.04mol/L}$×100%=80%,
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变为80%,
故答案为:0.022;0.09;80%;
(3)a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故a错误,
b.混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,故b错误,
c.可逆反应到达平衡时,各组分的浓度不发生变化,故c(A)不随时间改变,说明到达平衡,故c正确,
d.单位时间里生成C和D的物质的量相等,都表示正反应速率,反应始终按1:1生成C、D的物质的量,不能说明到达平衡,故d错误,
故答案为:c;
(4)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为$\frac{1}{0.4}$=2.5,
故答案为:2.5.
点评 本题考查化学平衡计算、平衡常数计算、化学反应速率、平衡状态判断,为高频考点,侧重于学生的分析能力和计算能力的考查,难度中等,注意化学平衡状态判断,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:实验题
CoCl2·6H2O是一种饲料营养强化剂。工业上利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
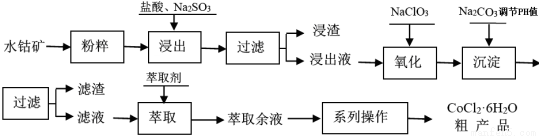
已知:① 浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
② CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
③ 部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01 mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)水钴矿进行预处理时加入Na2SO3,其主要作用是(用化学方程式说明) 。
(2)写出NaClO3在浸出液中发生主要反应的离子方程式 ;若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“系列操作”中包含3个基本实验操作依次是 、 和过滤。
(4)浸出液加Na2CO3调pH至5.2 时,所得滤液中金属离子有 ;萃取液中含有的主要金属阳离子是 。
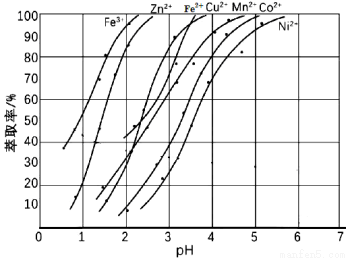
(5)为寻找合适的萃取剂,发现某种萃取剂对部分离子的萃取率与溶液pH 的关系如下图所示。请写出有关萃取规律,并说明本流程是否能用该萃取剂进行萃取。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
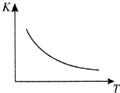 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:| 时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
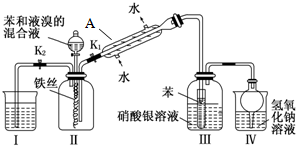
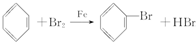
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
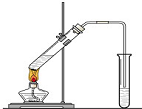 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
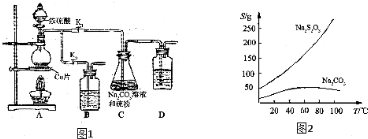
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
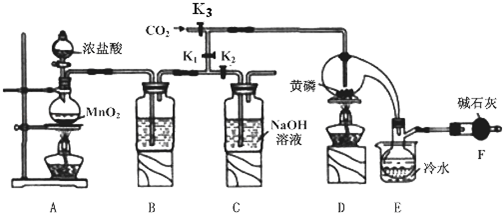
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com