考点:不同晶体的结构微粒及微粒间作用力的区别,离子化合物的结构特征与性质,共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:(1)含有离子键的化合物为离子化合物;微粒间通过分子间作用力结合的晶体为分子晶体;原子间通过共价键结合形成的空间网状的晶体为原子晶体;金属单质为金属晶体;
(2)共价化合物和非金属单质中只含有共价键;活泼金属与活泼非金属之间形成离子键;非金属之间形成共价键;
(3)根据晶体类型判断.
解答:
解:(1)氯化钠 和氢氧化钠中含有离子键属于离子晶体,则属于离子晶体的是⑥⑦;HCl分子间通过分子间作用力结合为分子晶体,所以属于分子晶体的是②;金刚石 和SiO2 中原子间通过共价键结合形成的空间网状为原子晶体,则属于原子晶体为:③⑤;金属单质为金属晶体,则铁和铜属于金属晶体;
故答案为:⑥⑦;②;③⑤;①④;
(2)共价化合物和非金属单质中只含有共价键,HCl、金刚石、SiO2 在只含有共价键;活泼金属与活泼非金属之间形成离子键,非金属之间形成共价键,只含有离子键的是NaCl,既含共价键又含离子键的是NaOH;
故答案为:②③⑤;⑥;⑦;
(3)氯化钠和氢氧化钠中含有离子键属于离子晶体,熔化时破坏离子键;金刚石和二氧化硅属于原子晶体,熔化时破坏共价键,HCl属于共价化合物溶于水时,共价键被破坏电离出氢离子和氯离子,所以克服共价键;
故答案为:⑥⑦;③⑤;②.
点评:本题考查了离子键、共价键、晶体类型的判断等,题目难度不大,注意把握不同晶体中微粒之间的作用力.




 表示的分子式
表示的分子式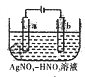 金属冶炼与处理常涉及氧化还原反应
金属冶炼与处理常涉及氧化还原反应