
【题目】草酸钙晶体(CaC2O4·H2O)是一种受热容易分解的盐,某班同学要探究其受热分解的产物,甲组同学认为其分解产物可能是CaCO3、CO和H2O,乙组同学认为其分解产物可能是CaO、CO2和H2O。两组同学将草酸钙晶体放入石英试管进行加热,按照下图所示装置进行探究,请回答相关问题。
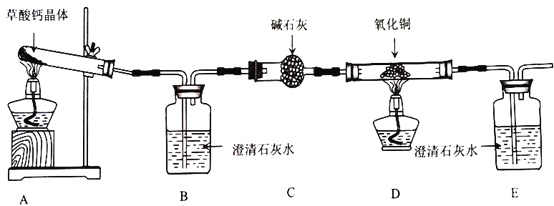
(1)盛放碱石灰的仪器名称是___________。证明分解产物中有CO的现象是______________________。
(2)装置存在一处明显缺陷,该缺陷是________________,改进的方法是______________________(任写一种)。
(3)实验中B中澄清石灰水未变浑浊,甲组同学认为自己的判断正确,但乙组同学认为可能是因为温度不够,需将试管下方酒精灯更换为___________重新实验。
(4)更换仪器及各种试剂后重新实验,B中澄清石灰水变浑浊,装置C的作用是______________________。
(5)更换仪器重新实验时发生的反应方程式是______________________。
【答案】(球形)干燥管 D中黑色固体变红,E中澄清石灰水变浑浊 缺少尾气处理装置(答案合理即可) 将末端导管口气体点燃或将末端导管口排出气体用气球收集起来 酒精喷灯 吸收二氧化碳和水蒸气以免干扰一氧化碳检验 CaC2O4·H2O![]() CaO+CO2↑+CO↑+H2O↑
CaO+CO2↑+CO↑+H2O↑
【解析】
(1)盛放碱石灰的仪器名称是(球形)干燥管;证明分解产物中有CO的现象是D中黑色固体变红同时E中澄清石灰水变浑浊;
(2)CO通过氧化铜后不一定完全反应,因此仍然需要对尾气进行处理,可点燃或者收集起来再处理;
(3)实验中B中澄清石灰水未变浑浊,说明没有CO2生成,原因可能是温度不够,则需将酒精灯更换为温度更高的酒精喷灯;
(4)由实验装置可知,装置D是CO还原氧化铜,在其后的E装置用来检验生成的CO2,从而证明分解产物中含有CO,所以装置C的作用是吸收二氧化碳和水蒸气以免干扰一氧化碳检验;
(5)CaC2O4·H2O在高温的条件下生成了CO2、CO和H2O,根据元素守恒,可判断同时生成CaO,据此写出反应方程式。
(1)由图可知,盛放碱石灰的仪器名称是(球形)干燥管;证明分解产物中有CO的现象是D中黑色固体变红,其后的E中澄清石灰水变浑浊;
因此,本题正确答案为:(球形)干燥管;D中黑色固体变红,E中澄清石灰水变浑浊;
(2)CO通过氧化铜后不一定完全反应,因此仍然需要对尾气进行处理,可点燃或者收集起来再处理;
因此,本题正确答案为:缺少尾气处理装置;将末端导管口气体点燃或将末端导管口排出气体用气球收集起来;
(3)实验中B中澄清石灰水未变浑浊,说明没有CO2生成,若是因为温度不够,则需将酒精灯更换为酒精喷灯后重新实验;
因此,本题正确答案为:酒精喷灯;
(4)由实验装置可知,装置D是CO还原氧化铜,在其后的E装置检验生成的CO2,从而证明分解产物中含有CO,所以装置C的作用是吸收二氧化碳和水蒸气以免干扰一氧化碳检验;
因此,本题正确答案为:吸收二氧化碳和水蒸气以免干扰一氧化碳检验;
(5)由实验现象可知,CaC2O4·H2O在高温的条件下生成了CO2、CO和H2O,根据元素守恒,可判断同时生成CaO,反应方程式是CaC2O4·H2O![]() CaO+CO2↑+CO↑+H2O↑,
CaO+CO2↑+CO↑+H2O↑,
因此,本题正确答案为:CaC2O4·H2O![]() CaO+CO2↑+CO↑+H2O↑。
CaO+CO2↑+CO↑+H2O↑。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有氮、硼、硒、钛、钴、钙等元素组成的化学物质。
(1)钙原子基态时的电子排布式为___________,金属钴堆积方式与镁相似,都属于六方最密堆积,其配位数是___________。
(2)氮元素的第一电离能在同周期中(稀有气体除外)从大到小排第___________位;写出与NO3-互为等电子体的一种非极性分子的化学式___________。
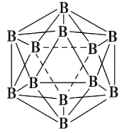
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),其中有两个原子为10B,其余为11B,则该结构单元有___________种不同的结构类型。已知硼酸(H3BO3)为一元弱酸,解释其为一元弱酸的原因____________________________________________。硼酸的结构与石墨相似,层内的分子以氢键相连,含lmol硼酸的晶体中有___________mol氢键。
(4)硒是动物体必需的营养元素。SeO2是硒的重要化合物,SeO2的价层电子对互斥模型是___________。
(5)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为TiCl3·6H2O的晶体,该晶体中两种配体的物质的量之比为1︰5,则该配离子的化学式为___________。
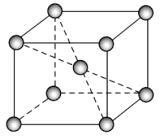
(6)钴晶体的一种晶胞是一种体心立方结构(如图所示),若该晶胞的边长为am,密度为ρg/cm3,NA表示阿伏加德罗常数的值,则钴的相对原子质量可表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不符合ⅦA族元素性质特征的是( )
A. 从上到下元素的非金属性增强
B. 除F外其他元素最高价氧化物对应的水化物可表示为HXO4(X指卤族元素)
C. 单质的熔沸点逐渐升高
D. 单质都能与H2直接化合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法错误的是
A. NaCl晶胞中Na+的配位数为6且构成正八面体
B. 由石墨比金刚石稳定可知:C(金刚石,s) ===C(石墨,s) ΔH>0
C. 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol。假设熔化热完全用于打破冰的氢键,最多能破坏冰中15%的氢键,则每摩尔冰中平均有2 mol氢键
D. 石墨中的碳原子采用sp2杂化构成平面层状结构,12g石墨中碳碳键数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)实验室制取Cl2的方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,其中MnO2发生了__反应,是__剂;每4分子氯化氢中只有___分子发生了___反应,盐酸是___剂。
MnCl2+Cl2↑+2H2O,其中MnO2发生了__反应,是__剂;每4分子氯化氢中只有___分子发生了___反应,盐酸是___剂。
(2)室温下KMnO4与浓盐酸反应制取氯气的化学方程式:2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑,请在上式中用单线桥法表示出不同元素的原子间得失电子的情况。___
(3)用CuCl2作催化剂,在450℃时用空气中的O2跟HCl反应也能制得氯气,其化学方程式:4HCl+O2![]() 2H2O+2Cl2,从氯元素化合价的变化看,以上三种制氯气方法的共同点是__;比较以上三个反应,可以认为氧化剂的氧化能力从强到弱的顺序为___。
2H2O+2Cl2,从氯元素化合价的变化看,以上三种制氯气方法的共同点是__;比较以上三个反应,可以认为氧化剂的氧化能力从强到弱的顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是常见的三种单质,A、B、C及其他物质之间的反应关系如图所示,其中B、D、E、F的水溶液呈酸性。若D+C→E+F,且常温下只有B为气态,则A、B、C分别为

A. Fe、Cl2、Cu
B. Fe、Cl2、H2
C. Cu、Cl2、Fe
D. Fe、Cl2、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。下列叙述不正确的是
CH3OH(g) ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。下列叙述不正确的是

A. 该反应的ΔH<0
B. 在500℃条件下达平衡时CO 的转化率为60%
C. 平衡常数K1(3000C)<K2(5000C)
D. 图2中达化学平衡的点为c、d、e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.2mol·L-1NaCN溶液中加入0.2mol·L-1的盐酸,溶液pH随所加盐酸体积的变化如图所示(M>7)。下列说法不正确的是

A. 25℃时,K(HCN)≈10-9.4
B. b点时,c(CN-)<c(HCN)
C. c点时,c(Cl-)>c(H+)+c(HCN)
D. a、b、c三点时,水的电离程度:a>b>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com