
【题目】(1)写出除杂所用试剂及方法(括号里面是杂质)
①溴苯(溴) 试剂__________;方法_____;
②乙烷(乙烯)试剂___;方法____;
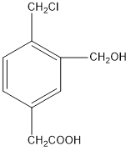
(2)某有机物的结构简式如图所示,若等物质的量的该有机物分别与足量Na、NaOH、NaHCO3恰好反应时,则消耗Na、NaOH、NaHCO3的物质的量之比是__________。
(3)有机物A只含有C、H、O三种元素,常用作有机合成的中间体。 16.8 g该有机物经燃烧生成44.0 gCO2和14.4 gH2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有-O-H键和位于分子端的-C≡C-键,核磁共振氢谱有三个峰,峰面积比为6:1:1。
①A的分子式是______ ; A的结构简式是_______;
②有机物B是A的同分异构体,1 mol B可与1mol Br2加成。该有机物所有碳原子在同一个平面,没有顺反异构现象。B的结构简式是_____;
【答案】氢氧化钠溶液 分液 溴水 洗气 2:2:1 C5H8O 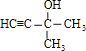 (CH3)2C=CHCHO
(CH3)2C=CHCHO
【解析】
(1)①溴可与氢氧化钠溶液反应,溴苯不与氢氧化钠溶液反应并分层不互溶,将氢氧化钠溶液和混合物加入到分液漏斗中,充分震荡,在进行分液;
答案为:氢氧化钠溶液;分液;
乙烯含有碳碳双键,可与溴水发生加成反应,可加入溴水洗气;
答案为:溴水;洗气;
(2)Na可与有机物中的醇羟基和羧基反应,1mol该有机物消耗2mol Na; NaOH可以和有机物中的羧基发生酸碱中和以及和氯甲基发生消去反应,1mol该有机物消耗2molNaOH;
NaHCO3只与有机物中的羧基反应,1mol该有机物消耗1mol NaHCO3,则消耗Na、NaOH、NaHCO3的物质的量之比是2:2:1。
答案为:2:2:1
(3)①有机物A只含有C. H、O三种元素,质谱图表明其相对分子质量为84,16.8g有机物A的物质的量=![]() =0.2mol,经燃烧生成44.0g CO2,物质的量为1mol,生成14.4g H2O,物质的量为
=0.2mol,经燃烧生成44.0g CO2,物质的量为1mol,生成14.4g H2O,物质的量为![]() =0.8mol,故有机物A分子中N(C)=
=0.8mol,故有机物A分子中N(C)=![]() =5,N(H)=
=5,N(H)=![]() 8,故N(O)=
8,故N(O)=![]() =1,故A的分子式为C5H8O;不饱和度为
=1,故A的分子式为C5H8O;不饱和度为![]() =2,红外光谱分析表明A分子中含有OH键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1,故分子中含有2个-CH3、1个OH连接在同一C原子上,故A的结构简式为
=2,红外光谱分析表明A分子中含有OH键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1,故分子中含有2个-CH3、1个OH连接在同一C原子上,故A的结构简式为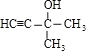 ;
;
故答案为:C5H8O;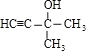
②有机物B是A的同分异构体,1molB可与1molBr2加成,故分子中含有1个C=C双键,该有机物所有碳原子在同一个平面,其余的碳原子连接C=C双键,没有顺反异构现象,不饱和双键至少其中一个C原子连接两个相同的基团甲基,结合A的结构简式可知,B中还含有CHO,故B为(CH3)2C=CHCHO;
故答案为:(CH3)2C=CHCHO;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于反应2SO2(g) + O2(g)![]() 2SO3(g) △H<0
2SO3(g) △H<0
①增加O2的浓度,平衡___移动,SO2的浓度___,SO3的物质的量___。
②增大压强,平衡___移动, SO2的浓度____,SO3的浓度___。
③升高温度,平衡____移动,SO2的浓度___,SO3的浓度____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3H2+N2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是
A. v正(N2)=v正(H2)B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】寿山石![]() 是我国四大印章石之首,被称为国石。X,Y,M,N是原子序数依次增大的短周期元素,M元素是地壳中含量最高的金属元素,N元素的单质常用来制造太阳能电池,
是我国四大印章石之首,被称为国石。X,Y,M,N是原子序数依次增大的短周期元素,M元素是地壳中含量最高的金属元素,N元素的单质常用来制造太阳能电池,![]() 和
和![]() 含有相同的电子数。下列说法正确的是
含有相同的电子数。下列说法正确的是
A.原子半径:![]()
B.简单氢化物的稳定性:![]()
C.第82号元素与M位于同一主族
D.X和M形成的化合物溶于水显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属混合粉末15g,与足量的盐酸反应时生成11.2L H2(标况下),符合上述情况的金属混合物是( )
A. Mg、Fe B. Zn、Ag C. Fe、Zn D. Mg、Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①![]()
![]()
②![]()
![]()
③断裂![]() 气体中的化学键需要吸收1076kJ的能量,断裂
气体中的化学键需要吸收1076kJ的能量,断裂![]() 气体中的化学键需要吸收1490kJ的能量。
气体中的化学键需要吸收1490kJ的能量。
请回答:
(1)断裂![]() 中所有化学键需要吸收的能量为________kJ。
中所有化学键需要吸收的能量为________kJ。
(2)T1℃时,向密闭容器中加入一定量的![]() 和C,发生反应①,达到平衡后
和C,发生反应①,达到平衡后![]() 的浓度为
的浓度为![]() ;其他条件不变,缩小容器体积,再次达到平衡时,
;其他条件不变,缩小容器体积,再次达到平衡时,![]() 的浓度为
的浓度为![]() ,则a________b(选填“>”“<”或“=”)。
,则a________b(选填“>”“<”或“=”)。
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的![]() 和CO发生反应②,测得相关数据如表所示:
和CO发生反应②,测得相关数据如表所示:
编号 | 容器 | 起始时物质的量/mol | 平衡时物质的量/mol | 平衡常数(K) | |
|
|
| |||
1 | 恒温 | 0.5 | 1.5 | 0.8 K1 | |
2 | 恒温 | 2 | 3 | M | K2 |
3 | 绝热 | 1 | 1.5 | n | K3 |
①T2℃时,容器1中反应的平衡常数K1=_______。
②容器2中,5min达到平衡,则0~5min以![]() 表示该反应的速率
表示该反应的速率![]() ___________。
___________。
③对于三个容器中的反应,下列说法正确的是(填字母)_________。
A.![]() B.容器1和容器2中
B.容器1和容器2中![]() 的平衡转化率
的平衡转化率![]()
C.![]() D.平衡时气体压强:
D.平衡时气体压强:![]()
(4)一定条件下,向恒压密闭容器中充入0.5mol ![]() 和1.0mol CO,发生反应②,CO和
和1.0mol CO,发生反应②,CO和![]() 的物质的量浓度(c)与时间(t)的关系如图所示:
的物质的量浓度(c)与时间(t)的关系如图所示:

①6min时改变的外界条件为________________。
②若在6min时,恒温将容器体积扩大到10L,请在图中画出6~10min![]() 的物质的量浓度随时间变化的曲线_________。
的物质的量浓度随时间变化的曲线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌—空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH+2H2O![]() Zn(OH)42-。下列说法不正确的是( )
Zn(OH)42-。下列说法不正确的是( )
A. 充电时,电解质溶液中K+向阴极移动
B. 充电时,电解质溶液中c(OH)逐渐增大
C. 放电时,负极反应为:Zn+4OH2e=Zn(OH)42-
D. 放电时,电路中通过2 mol电子,消耗氧气11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是 ( )
A. ![]() 有3种官能团
有3种官能团
B. 三元轴烯(![]() )与苯互为同分异构体
)与苯互为同分异构体
C. 乙苯分子中最多有7个碳原子在同一平面上
D. 烷烃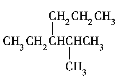 的正确命名是2甲基3丙基戊烷
的正确命名是2甲基3丙基戊烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com