
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A. | 氯化银、溴化银和碘化银的溶解度依次增大 | |
| B. | 将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀 | |
| C. | 在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)0.1 mol/L的AgNO3溶液,不能观察到白色沉淀 | |
| D. | 将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成 |
分析 A.结构相似的难溶性盐,溶度积越小,溶解度越小;
B.硫化银的溶度积比硫酸银小,从沉淀平衡移动的角度分析;
C.根据溶度积计算,当离子的浓度幂之积大于Ksp时,能生成沉淀,否则不生成沉淀;
D.当离子的浓度幂之积大于Ksp时,能生成沉淀.
解答 解:A.氯化银、溴化银和碘化银的溶度积依次减少,结构相似,溶度积越小,溶解度越小,故A错误;
B.硫化银的溶度积比硫酸银小,将硫酸银溶解于水后,向其中加入少量硫化钠溶液,可得到黑色沉淀,故B错误;
C.c(Cl-)=1.8×10-5mol/L×$\frac{5}{5+0.05}$,c(Ag+)=0.1mol/L×$\frac{0.05}{5+0.05}$,
则c(Cl-)×c(Ag+)=1.8×10-5mol/L×$\frac{5}{5+0.05}$×0.1mol/L×$\frac{0.05}{5+0.05}$>1.8×10-10(mol/L)2,能析出沉淀,故C错误;
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,如满足c(Cl-)×c(Ag+)>1.8×10-10,则可生成沉淀,故D正确.
故选D.
点评 本题考查难溶电解质的溶解平衡问题,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,本题注意根据溶度积计算,理解溶度积的意义,比较溶解度与溶度积之间的关系.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
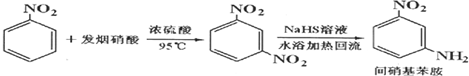
| 参考数据 | 组分 | 邻硝基苯胺 | 间硝基苯胺 | 对硝基苯胺 | 水 | 甲醇 | 硝基苯 |
| 沸点/℃ | 284 | 305.7 | 331.7 | 100 | 64.7 | 4.75 | |
| 偶极矩/D | 4.38 | 4.91 | 6.33 | 1.85 | 1.69 | 4.75 | |
| 颜色 | 橙色 | 淡黄色 | 淡黄色 | 无色 | 无色 | 淡黄色 |

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应开始时容器体积为2 L,则v(C)=0.4mol•L-1•min-1 | |
| B. | 若该反应在恒温恒容下进行,放出热量将增加 | |
| C. | 若2 min后,向容器中再投入等物质的量A、C,则B的转化率不变 | |
| D. | 若在恒压绝热条件下反应,平衡后n(C)<1.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应限度可衡量化学反应的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 可逆反应达到反应限度(化学平衡)时,正、逆反应速率相等 | |
| D. | 可以通过改变外界条件控制化学反应的限度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com