
| HNO3 |
| O2 |
| HNO3 |
| O2 |
| H2O |
| HNO3 |
| H2SO4 |
| Ba(NO3)2 |
| 22.4L |
| 22.4L/mol |
| 48g |
| 64g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、铁跟盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、氯气与水反应:Cl2+H2O═2H++Cl+ClO- |
| C、硫酸与氢氧化钡溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| D、金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,醋酸钠与醋酸的混合溶液pH=7,C(Na+)>c(CH3COO-) |
| B、0.1mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| C、将pH=6的H2SO4稀释1000倍后,c(H+)=2c(SO42-) |
| D、0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
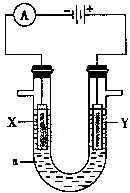 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.查看答案和解析>>
科目:高中化学 来源: 题型:

| PCl3 |
| △ |
| NaCN |
| H3O+ |
 的合成路线流程图(无机试剂任用)
的合成路线流程图(无机试剂任用)| NBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某条件下在密闭容器中发生反应X2+3Y2?2Z2,右图是反应过程中,反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
某条件下在密闭容器中发生反应X2+3Y2?2Z2,右图是反应过程中,反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A、0~t1时,X2、Y2、Z2的物质的量浓度由于反应进行而减小 |
| B、t2~t3时,反应体系中Y2的浓度没有变化 |
| C、到t3以后,反应已达限度,不管如何改变条件,反应不再进行 |
| D、从关系曲线可知,反应开始时体系中只有X2和Y2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com