
分析 (1)质量相同的H2O和D2O点的物质的量之比为$\frac{1}{18}$:$\frac{1}{20}$=10:9,所以质子数之比为10:9,中子数之比为10×8:9×10=8:9,由化学方程式知气体体积之比等于水的物质的量之比;
(2)根据氧化还原反应转移的电子的物质的量守恒,结合气体的总体积列式计算.
解答 解:(1)质量相同的H2O和D2O点的物质的量之比为$\frac{1}{18}$:$\frac{1}{20}$=10:9,所以质子数之比为10:9,中子数之比为10×8:9×10=8:9,由化学方程式知气体体积之比等于水的物质的量之比,即为:10:9;故答案为:10:9; 8:9;10:9;
(2)32.64g铜的物质的量为$\frac{32.64g}{64g/mol}$=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,
11.2L混合气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
设混合气体中含有xmolNO,ymolNO2,
则$\left\{\begin{array}{l}{x+y=0.5(质量守恒)}\\{3x+y=1.02(电子守恒)}\end{array}\right.$
解之得:$\left\{\begin{array}{l}{x=0.26}\\{y=0.24}\end{array}\right.$
混合气体中NO的体积是0.26×22.4=5824毫升; NO2的体积为5376毫升,故答案为:5824; 5376.
点评 本题考查化学方程式的计算,题目难度不大,注意从守恒的角度解答.


科目:高中化学 来源: 题型:选择题
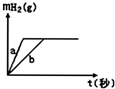
| A. | 曲线a为K,b为Na | B. | 投入的Na的质量大于K的质量 | ||
| C. | 投入的Na、K一定等质量 | D. | 稀盐酸的量一定是不足量的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
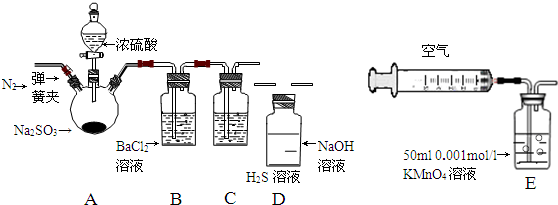
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管,滴入几滴酚酞 | 溶液变红 |
| 2 | 然后加入足量的BaCl2溶液 | 溶液中产生白色沉淀,最后若红色褪去,则说明①正确;若红色不能褪去,则说明②正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 1 mol甲基的电子数目为10NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
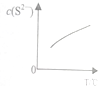 硫粉不溶于水、微溶于酒精,却易溶于Na2S溶液,发生如下反应:(x-1)S(s)+S2-(aq)?Sx2-(aq)(x≤6),达到平衡后,C(S2-)随温度T的变化如图所示.下列有关说法正确的是( )
硫粉不溶于水、微溶于酒精,却易溶于Na2S溶液,发生如下反应:(x-1)S(s)+S2-(aq)?Sx2-(aq)(x≤6),达到平衡后,C(S2-)随温度T的变化如图所示.下列有关说法正确的是( )| A. | 反应(x-1)S(s)+S2-(aq)?Sx2-(aq)的△H>0 | |
| B. | 该反应的平衡常数随温度的升高而减小 | |
| C. | 其他条件不变时,向平衡后的溶液中再加入硫粉,可使溶液中c(Sx2-)增大 | |
| D. | 依此原理,常温下Cl2在饱和NaCl溶液中的溶解度也比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Hm+2bX | B. | Hm-2bX | C. | Hm-8X | D. | H8-mX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由乙炔制氯乙烯;甲烷与氯气在光照条件下反应 | |
| B. | 溴乙烷和氢氧化钠乙醇溶液共热;乙醇制得乙烯 | |
| C. | 乙烯使溴的四氯化碳溶液褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 溴乙烷和氢氧化钠溶液共热;乙烯和氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙属同系物均可与氯气、溴蒸气发生取代反应 | |
| B. | C5H12表示一种纯净物 | |
| C. | 甲、乙、丙中,丙的沸点最低 | |
| D. | 乙有3种不同沸点的二氯取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当参加反应的O2等物质的量时,反应①、②中电子转移数目相等 | |
| B. | 反应①中氧化剂是氧气和水 | |
| C. | 与铜质水龙头连接处的钢质水管不易发生腐蚀 | |
| D. | 钢铁在潮湿的空气中不能发生电化学腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com